
Historie bromu, struktura, elektronová konfigurace, vlastnosti, použití
The bróm Jedná se o nekovový prvek, který patří do skupiny halogenů, skupiny 17 (VIIA) periodické tabulky. Jeho chemickým symbolem je Br. Vypadá to jako rozsivková molekula, jejíž atomy jsou spojeny kovalentní vazbou, pro kterou je přiřazen molekulární vzorec Brdva.
Na rozdíl od fluoru a chloru není brom v suchozemských podmínkách plyn, ale červenohnědá kapalina (obrázek níže). Je dýmavý a je spolu se rtutí, jedinými kapalnými prvky. Pod ním může jód, i když zesiluje svou barvu a zčervená, krystalizovat do těkavé pevné látky.

Brom objevil nezávisle v roce 1825 Carl Löwig, který studoval pod vedením německého chemika Leopolda Gmelina; a v roce 1826 francouzský chemik Antoine-Jérome Balard. Zveřejnění Balardových experimentálních výsledků však předcházelo Löwigově..
Brom je 62. nejhojnějším prvkem na Zemi a je distribuován v nízkých koncentracích po celé zemské kůře. V moři je průměrná koncentrace 65 ppm. Lidské tělo obsahuje 0,0004% bromu a jeho funkce není definitivně známa..
Tento prvek je komerčně využíván ve slaných nálevech nebo na místech, která jsou kvůli zvláštním podmínkám místy s vysokou koncentrací solí; například Mrtvé moře, ke kterému se sbíhají vody sousedních území, nasycené solemi.
Jedná se o korozivní prvek schopný napadat kovy, jako je platina a palladium. Brom rozpuštěný ve vodě může také působit korozivně na lidské tkáně, což zhoršuje situaci, protože může vznikat kyselina bromovodíková. Pokud jde o jeho toxicitu, může způsobit významné poškození orgánů, jako jsou játra, ledviny, plíce a žaludek.
Brom je v atmosféře velmi škodlivý a je 40–100krát ničivější pro ozonovou vrstvu než chlor. Polovina ztráty ozonové vrstvy v Antarktidě je způsobena reakcemi souvisejícími s brommethylem, sloučeninou používanou jako fumigant.
Má mnoho použití, například: retardér hoření, bělicí prostředek, povrchový dezinfekční prostředek, přísada do paliva, meziprodukt při výrobě sedativ, při výrobě organických chemikálií atd..
Rejstřík článků
- 1 Historie
- 1.1 Práce Carla Löwiga
- 1.2 Práce Antoina Balarda
- 2 Struktura a elektronová konfigurace bromu
- 2.1 Molekula
- 2.2 Krystaly
- 2.3 Valenční vrstva a oxidační stavy
- 3 Vlastnosti
- 3.1 Fyzický vzhled
- 3.2 Atomová hmotnost
- 3,3 atomové číslo
- 3.4 Zápach
- 3.5 Bod tání
- 3.6 Bod varu
- 3.7 Hustota (Br2) kapalina
- 3.8 Rozpustnost ve vodě
- 3.9 Rozpustnosti
- 3.10 Trojitý bod
- 3.11 Kritický bod
- 3.12 Fúzní teplo (Br2)
- 3.13 Odpařovací teplo (Br2)
- 3.14 Molární tepelná kapacita (Br2)
- 3.15 Tlak par
- 3.16 Teplota automatického zapalování
- 3.17 Bod vzplanutí
- 3.18 Skladovací teplota
- 3.19 Povrchové napětí
- 3.20 Prahová hodnota zápachu
- 3.21 Index lomu (ηD)
- 3.22 Elektronegativita
- 3.23 Ionizační energie
- 3.24 Atomový poloměr
- 3.25 Kovalentní poloměr
- 3.26 Poloměr Van der Waals
- 3.27 Reaktivita
- 4 použití
- 4.1 Aditivum do benzínu
- 4.2 Pesticidy
- 4.3 Kontrola emisí rtuti
- 4.4 Fotografie
- 4.5 Terapeutické akce
- 4.6 Zpomalovač hoření
- 4.7 Potravinářská přídatná látka
- 4.8 Činidla a chemický meziprodukt
- 4.9 Biologický účinek
- 5 Kde najít
- 6 Rizika
- 7 Reference
Příběh
Práce Carla Löwiga
Brom objevil nezávisle a téměř současně německý chemik Carl Jacob Löwig v roce 1825 a francouzský chemik Antoine Balard v roce 1826..
Carl Löwig, žák německého chemika Leopolda Gmelina, shromáždil vodu z pramene v Bad Kreuznach a přidal do něj chlor; po přidání etheru se kapalná směs míchá.
Poté byl ether oddestilován a odpařen. Jako výsledek získal červenohnědou látku, kterou byl brom.
Práce Antoina Balarda
Balard použil popel z hnědých řas známých jako fucus a smíchal je se solným roztokem extrahovaným ze solných plání v Montpellier. Uvolnil tedy brom a nechal chlor procházet vodným materiálem, který byl podroben extrakci, ve které byl přítomen bromid hořečnatý, MgBr.dva.
Následně byl materiál destilován v přítomnosti oxidu manganičitého a kyseliny sírové za vzniku červených par, které kondenzovaly na tmavou kapalinu. Balard si myslel, že je to nový prvek, a nazval jej muride, odvozený z latinského slova muria, kterým byl označen solanka.
Bylo poznamenáno, že Balard změnil název z Muride na Brôme na popud Anglady nebo Gay-Lussaca na základě skutečnosti, že brôme znamená faul, který definuje vůni objeveného prvku..
Výsledky byly publikovány Belardem v Annales of Chemie and Physique, než Löwig publikoval své.
Teprve od roku 1858 bylo možné produkovat brom ve významných množstvích; rok byly objeveny a využity ložiska soli Stassfurt, které poskytly brom jako vedlejší produkt potaše.
Struktura a elektronová konfigurace bromu
Molekula

Horní obrázek ukazuje molekulu bromu, Brdva, s kompaktním plnicím modelem. Ve skutečnosti existuje jednoduchá kovalentní vazba mezi dvěma atomy bromu, Br-Br.
Jelikož jde o homogenní a rozsivkovou molekulu, postrádá trvalý dipólový moment a může interagovat pouze s ostatními stejného typu pomocí Londonových disperzních sil..
To je důvod, proč jeho rudá kapalina kouří; v molekulách Brdva, i když jsou relativně těžké, jejich mezimolekulární síly je drží volně pohromadě.
Brom je méně elektronegativní než chlor, a proto má méně atraktivní účinek na elektrony ve valenčních skořápkách. Výsledkem je, že k cestování po vyšších energetických hladinách, pohlcování zelených fotonů a odrážení načervenalé barvy vyžaduje méně energie..
Krystaly
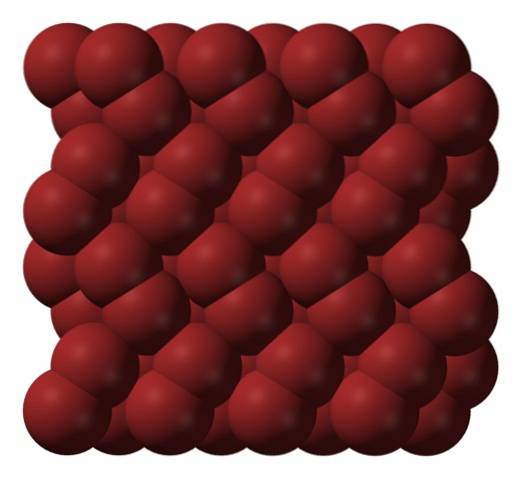
V plynné fázi molekuly Brdva značně se oddělují, dokud mezi nimi nedojde k účinné interakci. Avšak pod svou teplotou tání může brom zamrznout na načervenalé ortorombické krystaly (horní obrázek).
Všimněte si, jak molekuly Brdva jsou uspořádány úhledně tak, že vypadají jako „bromoví červi“. Tady a při těchto teplotách (T < -7,2°C), las fuerzas de dispersión son suficientes para que las vibraciones de las moléculas no desmoronen el cristal en el acto; pero aún así, varias de ellas sublimarán constantemente.
Valenční vrstva a oxidační stavy
Elektronová konfigurace bromu je:
[Ar] 3d104 sdva 4p5
Být 3d104 sdva 4p5 jeho valenční skořápka (ačkoli 3d orbitální10 nehrají vedoucí roli v jejich chemických reakcích). Elektrony na orbitálech 4s a 4p jsou nejvzdálenější a tvoří celkem 7, pouze jeden elektron z dokončení valenčního oktetu.
Z této konfigurace lze odvodit možné oxidační stavy pro brom: -1, pokud získá elektron, který bude izoelektronický vůči kryptonu; +1, zbývající jako 3d104 sdva 4p4; +3, +4 a +5, ztrácí všechny elektrony z orbitálu 4p ([Ar] 3d104 sdva4p0); a +7, nezanechávající žádné elektrony na 4s orbitálu ([Ar] 3d104 s04p0).
Vlastnosti
Fyzický vzhled
Tmavě červenohnědá dýmavá kapalina. V přírodě se vyskytuje jako rozsivková molekula s atomy spojenými kovalentní vazbou. Brom je kapalina hustší než voda a klesá v ní.
Atomová hmotnost
79,904 g / mol.
Protonové číslo
35.
Zápach
Štiplavý, dusivý a dráždivý kouř.
Bod tání
-7,2 ° C.
Bod varu
58,8 ° C.
Hustota (Brdva) kapalný
3,1028 g / cm3
Rozpustnost ve vodě
33,6 g / l při 25 ° C Rozpustnost bromu ve vodě je nízká a má tendenci se zvyšovat s klesající teplotou; chování podobné jiným plynům.
Rozpustnosti
Je snadno rozpustný v alkoholu, etheru, chloroformu, tetrachlormethanu, sirouhlíku a koncentrované kyselině chlorovodíkové. Rozpustný v nepolárních a některých polárních rozpouštědlech, jako je alkohol, kyselina sírová a mnoho halogenovaných rozpouštědel.
Trojitý bod
265,9 K až 5,8 kPa.
Kritický bod
588 K při 10,34 MPa.
Fúzní teplo (Brdva)
10 571 kJ / mol.
Odpařovací teplo (Brdva)
29,96 kJ / mol.
Molární tepelná kapacita (Brdva)
75,69 kJ / mol.
Tlak páry
Při teplotě 270 K, 10 kPa.
Teplota samovznícení
Nehořlavý.
bod vznícení
113 ° C.
Skladovací teplota
2 až 8 ° C.
Povrchové napětí
40,9 mN / m při 25 ° C.
Prahová hodnota zápachu
0,05 - 3,5 ppm. 0,39 mg / m3
Index lomu (ηD)
1,6083 při 20 ° C a 1,6478 při 25 ° C.
Elektronegativita
2,96 na Paulingově stupnici.
Ionizační energie
- První úroveň: 1 139,9 kJ / mol.
- Druhá úroveň: 2 103 kJ / mol.
- Třetí úroveň: 3 470 kJ / mol.
Atomové rádio
120 hodin.
Kovalentní poloměr
120,3 hodin.
Van der Waalsovo rádio
185 hodin.
Reaktivita
Je méně reaktivní než chlor, ale reaktivnější než jód. Je to oxidant méně silný než chlor a silnější než jod. Je to také slabší redukční činidlo než jód, ale silnější než chlor..
Pára chloru je vysoce korozivní pro mnoho materiálů a lidských tkání. Útočí na mnoho kovových prvků, včetně platiny a palladia; ale nenapadá olovo, nikl, hořčík, železo, zinek a pod 300 ° C ani sodík.
Brom ve vodě podléhá změně a mění se na bromid. Může také existovat jako bromičnan (BrO3-), v závislosti na pH kapaliny.
Díky svému oxidačnímu účinku může brom vyvolávat uvolňování volných radikálů kyslíku. Jedná se o silná oxidační činidla a mohou způsobit poškození tkáně. Brom se také může spontánně vznítit v kombinaci s draslíkem, fosforem nebo cínem..
Aplikace
Benzinová přísada
Ethylen dibromid byl použit k odstranění potenciálních usazenin olova z automobilových motorů. Po spalování benzínu, který používal jako přísadu olovo, se v kombinaci s olovem vytvořil bromid olovnatý, těkavý plyn, který byl vypuzen výfukovým potrubím..
I když brom odstranil z benzínu olovo, jeho destruktivní působení na ozonovou vrstvu bylo velmi silné, a proto bylo pro tuto aplikaci vyřazeno.
Pesticidy
Methylen nebo brommethylbromid byl použit jako pesticid k čištění půdy, zejména k eliminaci parazitických hlístic, jako je měchovec..
Avšak použití většiny sloučenin obsahujících brom bylo vyřazeno kvůli jejich destruktivnímu působení na ozonovou vrstvu..
Kontrola emisí rtuti
Brom se v některých zařízeních používá ke snížení emisí rtuti, velmi toxického kovu..
Fotografování
Bromid stříbrný se kromě jodidu stříbrného a chloridu stříbrného používá jako sloučenina citlivá na světlo ve fotografických emulzích.
Terapeutické akce
Bromid draselný, stejně jako bromid lithný, byly používány jako obecná sedativa v 19. a na počátku 20. století. Bromidy ve formě jednoduchých solí se v některých zemích stále používají jako antikonvulziva.
Americká FDA však dnes neschvaluje použití bromu k léčbě jakéhokoli onemocnění..
Zpomalovač ohně
Brom je plameny přeměňován na kyselinu bromovodíkovou, která narušuje oxidační reakci, ke které dochází při požáru, a způsobuje její vyhynutí. Polymery obsahující brom se používají k výrobě ohnivzdorných pryskyřic.
Potravinářská přídatná látka
Do mouky byly přidány stopy bromičnanu draselného, aby se zlepšilo vaření.
Činidla a chemický meziprodukt
Bromovodík se používá jako redukční činidlo a katalyzátor pro organické reakce. Brom se používá jako chemický meziprodukt při výrobě léčiv, hydraulických kapalin, chladicích látek, odvlhčovačů a v přípravcích na zvlnění vlasů.
Rovněž nachází uplatnění při výrobě kapalin pro vrtání studní, produktů pro dezinfekci vody, bělících prostředků, povrchových dezinfekčních prostředků, barviv, přísad do paliv atd..
Biologické působení
Studie provedená v roce 2014 naznačuje, že brom je nezbytným kofaktorem pro biosyntézu kolagenu IV, díky čemuž je brom nezbytným prvkem pro vývoj zvířecích tkání. Neexistují však žádné informace o důsledcích deficitu prvku.
Kde se to nachází
Brom se komerčně získává ze solných dolů a hlubinných nádrží nacházejících se ve státě Arkansas a ve Velkém solném jezeře v Utahu, a to jak ve Spojených státech. Tato poslední solanka má koncentraci bromu 0,5%.
Pro extrakci bromu se do solanky přidá horký plynný chlor, aby se oxidovaly bromidové ionty v roztoku, přičemž se zachytí elementární brom..
Mrtvé moře, na hranici mezi Jordánskem a Izraelem, je uzavřené moře pod hladinou moře, díky čemuž má velmi vysokou koncentraci solí.
Brom a potaš se tam získávají komerčně odpařováním vysoce slané vody z Mrtvého moře. V tomto moři může koncentrace bromu dosáhnout 5 g / l.
Vyskytuje se také ve vysokých koncentracích v některých horkých pramenech. Brominit je například minerál bromidu stříbrného nacházející se v Bolívii a Mexiku..
Rizika
Brom v kapalném stavu je korozivní pro lidské tkáně. Ale největší nebezpečí pro člověka pochází z par bromu a jejich vdechování..
Dýchání v prostředí s koncentrací bromu 11-23 mg / m3 produkuje silné šoky. Koncentrace 30-60 mg / m3 je to extrémně škodlivé. Mezitím může být koncentrace 200 mg smrtelná.
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Národní centrum pro biotechnologické informace. (2019). Bróm. Databáze PubChem. CID = 23968. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Ross Rachel. (8. února 2017). Fakta o bromu. Obnoveno z: livesscience.com
- Wikipedia. (2019). Borax. Obnoveno z: en.wikipedia.org
- Lenntech B.V. (2019). Bróm. Obnoveno z: lenntech.com



Zatím žádné komentáře