
Vlastnosti, vlastnosti a použití chromu

The chrom (Cr) je kovový prvek skupiny 6 (VIB) periodické tabulky. Tuny tohoto kovu se ročně produkují jeho extrakcí z minerálního chromitu, železa nebo hořčíku (FeCrdvaNEBO4, MgCrdvaNEBO4), které jsou redukovány uhlíkem za získání kovu. Je velmi reaktivní a pouze za velmi redukčních podmínek se nachází v čisté formě.
Jeho název je odvozen z řeckého slova „chroma“, což znamená barva. Toto jméno dostalo kvůli mnoha a intenzivním barvám, které vykazují sloučeniny chrómu, ať už anorganické nebo organické; od černých pevných látek nebo roztoků po žluté, oranžové, zelené, fialové, modré a červené.

Barva kovového chromu a jeho karbidů je však stříbřitě šedivá. Tato charakteristika je využívána v technice chromování k získání mnoha struktur stříbrných jisker (jako ty, které jsou vidět na krokodýli na obrázku výše). Díky „koupání s chromem“ tak získávají kousky lesk a velkou odolnost proti korozi..
Chrom v roztoku rychle reaguje s kyslíkem ve vzduchu za vzniku oxidů. V závislosti na pH a oxidačních podmínkách média může získat různá oxidační čísla, přičemž je (III) (Cr3+) nejstabilnější ze všech. Následkem toho je oxid chromitý (CrdvaNEBO3) zelená barva je nejstabilnější z jeho oxidů.
Tyto oxidy mohou interagovat s jinými kovy v prostředí, což způsobuje například pigment sibiřské červené olovo (PbCrO4). Tento pigment je žlutooranžový nebo červený (podle své zásaditosti) a francouzský vědec Louis Nicolas Vauquelin z něj izoloval kovovou měď, a proto je oceněn jako jeho objevitel.
Jeho minerály a oxidy, stejně jako nepatrná část kovové mědi, činí tento prvek obsazeným číslem 22 nejhojnějších v zemské kůře..
Chemie chrómu je velmi různorodá, protože může vytvářet vazby s téměř celou periodickou tabulkou. Každá z jejích sloučenin vykazuje barvy, které závisí na oxidačním čísle a také na druzích, které s ním interagují. Podobně vytváří vazby s uhlíkem a zasahuje do velkého počtu organokovových sloučenin..
[TOC]
Vlastnosti a vlastnosti
Chrom je stříbřitý kov v čisté formě, s atomovým číslem 24 a molekulovou hmotností přibližně 52 g / mol (52Cr, jeho nejstabilnější izotop).
Vzhledem ke svým silným kovovým vazbám má vysoké teploty tání (1907 ° C) a teploty varu (2671 ° C). Díky své krystalické struktuře je také velmi hustým kovem (7,19 g / ml).
Nereaguje s vodou za vzniku hydroxidů, ale reaguje s kyselinami. Oxiduje kyslíkem ve vzduchu, obecně produkuje oxid chromitý, což je široce používaný zelený pigment..
Tyto oxidové vrstvy vytvářejí tzv pasivace, chrání kov před následnou korozí, protože kyslík nemůže proniknout do kovového sinu.
Jeho elektronová konfigurace je [Ar] 4s13d5, se všemi nespárovanými elektrony, a proto vykazuje paramagnetické vlastnosti. K párování elektronických točení však může dojít, pokud je kov vystaven nízkým teplotám a získá další vlastnosti, jako je antiferromagnetismus.
Rejstřík článků
- 1 Vlastnosti a vlastnosti
- 2 Chemická struktura chrómu
- 3 oxidační číslo
- 3,1 Cr (-2, -1 a 0)
- 3,2 Cr (I) a Cr (II)
- 3,3 Cr (III)
- 3,4 Cr (IV) a Cr (V)
- 3,5 Cr (VI): chroman-dichromanový pár
- 4 Použití chrómu
- 4.1 Jako barvivo nebo pigmenty
- 4.2 V chromování nebo metalurgii
- 4.3 Nutriční
- 5 Kde je?
- 6 Reference
Chromová chemická struktura
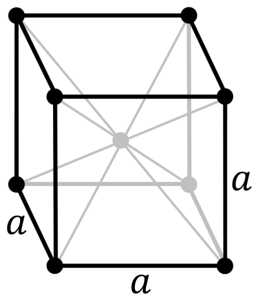
Jaká je struktura chromovaného kovu? Ve své čisté formě předpokládá chrom kubickou (cc nebo bcc) krystalovou strukturu zaměřenou na tělo. To znamená, že atom chrómu je umístěn ve středu krychle, jejíž okraje jsou obsazeny jinými chromy (jako na obrázku výše).
Tato struktura je zodpovědná za chrom, který má vysoké teploty tání a varu a také velkou tvrdost. Atomy mědi překrývají své orbitaly s a d a vytvářejí vodivé pásy podle teorie pásma.
Obě pásma jsou tedy napůl plná. Proč? Protože jeho elektronová konfigurace je [Ar] 4s13d5 a protože s orbitál může pojmout dva elektrony a d orbitaly deset. Pak pouze polovina pásů vytvořených jejich překryvy je obsazena elektrony..
S těmito dvěma pohledy - krystalickou strukturou a kovovou vazbou - lze teoreticky vysvětlit mnoho fyzikálních vlastností tohoto kovu. Ani jeden však nevysvětluje, proč může mít chrom různé oxidační stavy nebo čísla..
To by vyžadovalo hluboké pochopení stability atomu s ohledem na elektronická otočení..
Oxidační číslo
Protože elektronová konfigurace chromu je [Ar] 4s13d5 může získat až jeden nebo dva elektrony (Cr1- a ČRdva-), nebo je ztratit, abyste získali různá oxidační čísla.
Pokud tedy chrom ztratí elektron, zůstal by jako [Ar] 4s03d5; pokud ztratí tři, [Ar] 4s03d3; a pokud je všechny ztratí, [Ar], nebo co se rovná, bylo by izoelektronické pro argon.
Chrom neztrácí ani nezískává elektrony pouhým rozmarem: musí existovat druh, který je daruje nebo přijímá, aby přešli z jednoho oxidačního čísla na druhé.
Chrom má následující oxidační čísla: -2, -1, 0, +1, +2, +3, +4, +5 a +6. Z toho +3, Cr3+, je nejstabilnější, a proto převládá ze všech; následovaný +6, Cr6+.
Cr (-2, -1 a 0)
Chrom je vysoce nepravděpodobné, že získá elektrony, protože je to kov, a proto je jeho podstatou je darovat je. Může se však koordinovat s ligandy, to znamená molekulami, které interagují s kovovým středem prostřednictvím dativní vazby..
Jedním z nejznámějších je oxid uhelnatý (CO), který tvoří hexakarbonylovou sloučeninu chrómu.
Tato sloučenina má molekulární vzorec Cr (CO)6, a protože ligandy jsou neutrální a neposkytují žádný náboj, má Cr oxidační číslo 0.
To lze pozorovat také u jiných organokovových sloučenin, jako je bis (benzen) chrom. V druhém případě je chrom obklopen dvěma benzenovými kruhy v molekulární struktuře sendvičového typu:
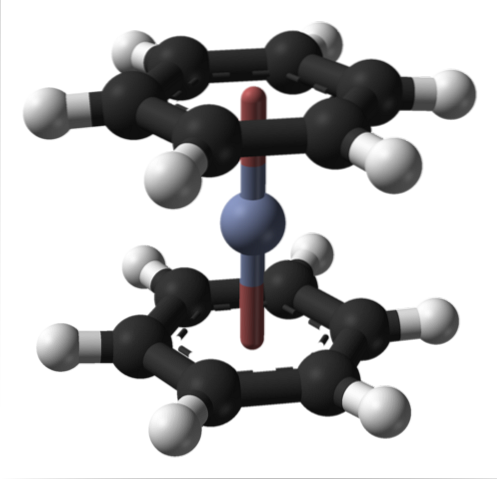
Z těchto dvou organokovových sloučenin může z Cr (0) vzniknout mnoho dalších.
Soli byly nalezeny tam, kde interagují s sodnými kationty, což znamená, že Cr musí mít negativní oxidační číslo, aby přilákal kladné náboje: Cr (-2), Nadva[Cr (CO)5] a Cr (-1), Nadva[Crdva(CO)10].
Cr (I) a Cr (II)
Cr (I) nebo Cr1+ Vyrábí se oxidací právě popsaných organokovových sloučenin. Toho je dosaženo oxidací ligandů, jako je CN nebo NO, čímž se vytvoří například sloučenina K.3[Cr (CN)5NE].
Zde je skutečnost, že máme tři K. kationty+ Znamená to, že komplex chrómu má tři záporné náboje; také ligand CN- přispívá pěti zápornými náboji, takže mezi Cr a NO musí být přidány dva kladné náboje (-5 + 2 = -3).
Pokud je NO neutrální, pak je to Cr (II), ale pokud má kladný náboj (NO+), je v tom případě Cr (I).
Na druhou stranu jsou sloučeniny Cr (II) hojnější, včetně následujících: chlorid chromitý (CrCl)dva), octan chromitý (Crdva(NEBOdvaCCH3)4), oxid chromitý (CrO), sulfid chromitý (CrS) a další.
Cr (III)
Ze všeho je to ten s největší stabilitou, protože je ve skutečnosti produktem mnoha oxidačních reakcí chromanových iontů. Jeho stabilita je pravděpodobně způsobena jeho elektronickou konfigurací d3, ve kterém tři elektrony zabírají tři d-orbitaly s nižší energií ve srovnání s dalšími dvěma energičtějšími (rozdělení d orbitalů).
Nejreprezentativnější sloučeninou tohoto oxidačního čísla je oxid chromitý (CrdvaNEBO3). V závislosti na ligandech, které se s ním koordinují, bude komplex vykazovat jednu nebo druhou barvu. Příklady těchto sloučenin jsou: [CrCldva(HdvaNEBO)4] Cl, Cr (OH)3, CrF3, [Cr (HdvaNEBO)6]3+, atd.
Ačkoli chemický vzorec to na první pohled neukazuje, chrom má obvykle ve svých komplexech oktaedrickou koordinační sféru; to znamená, že je umístěn ve středu osmistěnu, kde jsou jeho vrcholy umístěny ligandy (celkem šest).
Cr (IV) a Cr (V)
Sloučeniny, kterých se Cr účastní5+ je jich velmi málo, kromě toho, že jsou snadno oxidovány na Cr, kvůli elektronické nestabilitě uvedeného atomu6+, mnohem stabilnější, protože je izoelektronický ve srovnání s argonovým vzácným plynem.
Sloučeniny Cr (V) však lze syntetizovat za určitých podmínek, jako je vysoký tlak. Podobně mají tendenci se rozkládat při mírných teplotách, což znemožňuje jejich možné aplikace, protože nemají tepelný odpor. Některé z nich jsou: CrF5 a K.3[Cr (O.dva)4] (O.dvadva- je peroxidový anion).
Na druhé straně Cr4+ je relativně stabilnější a je schopen syntetizovat své halogenované sloučeniny: CrF4, CrCl4 a CrBr4. Jsou však také náchylné k rozkladu redoxními reakcemi za vzniku atomů chrómu s lepšími oxidačními čísly (například +3 nebo +6)..
Cr (VI): chroman-dichromanový pár
2 [CrO4]dva- + 2H+ (Žlutá) => [CrdvaNEBO7]dva- + HdvaO (oranžová)
Výše uvedená rovnice odpovídá kyselé dimerizaci dvou chromanových iontů za vzniku dichromanu. Kolísání pH způsobuje změnu v interakcích kolem kovového centra Cr6+, také patrné na barvě roztoku (od žluté po oranžovou nebo naopak). Dichromát se skládá z O můstku3Cr-O-CrO3.
Sloučeniny Cr (VI) mají vlastnosti, že jsou škodlivé a dokonce karcinogenní pro lidské tělo a zvířata.
Jak? Studie tvrdí, že ionty CrO4dva- křížové buněčné membrány působením proteinů přenášejících síran (oba ionty jsou ve skutečnosti podobné velikosti).
Redukční činidla v buňkách redukují Cr (VI) na Cr (III), který se hromadí nevratnou koordinací na konkrétní místa na makromolekulách (jako je DNA).
Znečištěná buňka přebytkem chrómu nemůže opustit kvůli nedostatku mechanismu, který ji transportuje zpět přes membrány.
Použití chromu
Jako barvivo nebo pigmenty
Chrom má široké spektrum použití, od barviva pro různé typy tkanin, až po chránič, který zdobí kovové části známým jako chromování, které lze vyrobit z čistého kovu nebo se sloučeninami Cr (III) nebo Cr (VI).
Fluorid chromitý (CrF3) se například používá jako barvivo pro vlněné látky; síran chromitý (Crdva(SW4)3), používá se k barvení emailů, keramiky, barev, inkoustů, laků a také k chromování kovů; a oxid chromitý (CrdvaNEBO3) také najde použití tam, kde je požadována atraktivní zelená barva.
Proto může být jakýkoli minerál chrómu s intenzivními barvami určen k barvení struktury, ale poté se objeví skutečnost, zda jsou tyto sloučeniny nebezpečné nebo ne pro životní prostředí nebo pro zdraví jednotlivců.
Ve skutečnosti se jeho jedovaté vlastnosti používají k ochraně dřeva a jiných povrchů před napadením hmyzem..
V chromu nebo metalurgii
Do oceli se také přidává malé množství chromu, aby se posílila proti oxidaci a zlepšil její lesk. Je to proto, že je schopen tvořit šedavé karbidy (Cr3Cdva) velmi odolný vůči reakci s kyslíkem ve vzduchu.
Vzhledem k tomu, že chrom lze leštit na lesklé povrchy, nabízí chrom pro tyto účely jako levnější alternativu stříbrné vzory a barvy..
Nutriční
Někteří diskutují o tom, zda lze chrom považovat za základní prvek, tj. Nepostradatelný v každodenní stravě. Je přítomen v některých potravinách ve velmi malé koncentraci, jako jsou zelené listy a rajčata..
Podobně existují proteinové doplňky, které regulují aktivitu inzulínu a podporují růst svalů, jako je tomu u polynikotinátu chromitého.
Kde se to nachází?

Chrom se nachází v široké škále minerálů a drahokamů, jako jsou rubíny a smaragdy. Hlavním minerálem, ze kterého se chrom extrahuje, je chromit (MCrdvaNEBO4), kde M může být jakýkoli jiný kov, se kterým je spojen oxid chromitý. Těží se v Jižní Africe, Indii, Turecku, Finsku, Brazílii a dalších zemích.
Každý zdroj má jednu nebo více chromitových variant. Tímto způsobem vzniká pro každý M (Fe, Mg, Mn, Zn atd.) Jiný chromový minerál.
K extrakci kovu je nutné redukovat minerál, to znamená zajistit, aby centrum kovového chrómu získalo elektrony působením redukčního činidla. To se provádí pomocí uhlíku nebo hliníku:
FeCrdvaNEBO4 + 4C => Fe + 2Cr + 4CO
Také chromit (PbCrO4).
Obecně platí, že v jakémkoli minerálu, kde je iont Cr3+ může nahradit Al3+, oba s mírně podobnými iontovými poloměry, představují nečistotu, která vede k dalšímu přirozenému zdroji tohoto úžasného, ale škodlivého kovu.
Reference
- Tenenbaum E. Chrom. Převzato z: chemistry.pomona.edu
- Wikipedia. (2018). Chrom. Převzato z: en.wikipedia.org
- Anne Marie Helmenstine, Ph.D. (6. dubna 2018). Jaký je rozdíl mezi Chrome a Chromem? Převzato z: thoughtco.com
- N.V. Mandich. (devatenáct devadesát pět). Chemie chromu. [PDF]. Převzato z: citeseerx.ist.psu.edu
- Chemistry LibreTexts. Chemie chromu. Převzato z: chem.libretexts.org
- Saul 1. Shupack. (1991). Chemie chromu a některé výsledné analytické problémy. Recenze od: ncbi.nlm.nih.gov
- Advameg, Inc. (2018). Chrom. Převzato z: chemistryexplained.com



Zatím žádné komentáře