
Jaké jsou úrovně organizace hmoty? (s příklady)

The úrovně organizace hmoty Jsou to ty fyzické projevy, které tvoří Vesmír v jeho různých hmotnostních měřítcích. Ačkoli, i když lze z fyziky vysvětlit mnoho jevů, existují oblasti tohoto rozsahu, které více odpovídají studiím chemie, biologie, mineralogie, ekologie, astronomie a dalších přírodních věd..
U základu hmoty máme subatomární částice studované fyzikou částic. Lezeme po schodech vaší organizace, vstupujeme do oblasti chemie a pak se dostáváme k biologii; z rozpadlé a energetické hmoty skončí pozorováním mineralogických těl, živých organismů a planet.
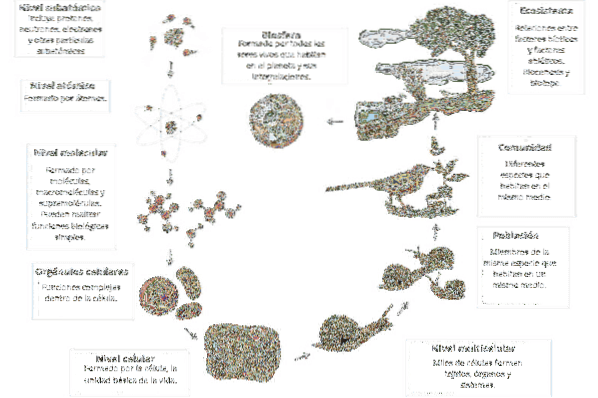
Úrovně organizace hmoty jsou integrované a soudržné, aby definovaly těla jedinečných vlastností. Například buněčná úroveň je tvořena subatomárními, atomovými, molekulárními a celulárními, ale má vlastnosti, které se od všech liší. Stejně tak mají horní úrovně různé vlastnosti.
Jaké jsou úrovně organizace hmoty?
Předmět je organizován do následujících úrovní:
Subatomová úroveň
Začínáme s nejnižší příčkou: s částicemi menšími než samotný atom. Tento krok je předmětem studia ve fyzice částic. Velmi zjednodušeným způsobem máme kvarky (nahoru a dolů), leptony (elektrony, miony a neutrina) a nukleony (neutrony a protony).
Hmotnost a velikost těchto částic jsou tak zanedbatelné, že se konvenční fyzika nepřizpůsobuje jejich chování, takže je nutné je studovat pomocí hranolu kvantové mechaniky..
Atomová úroveň
Stále v oblasti fyziky (atomové a jaderné) zjistíme, že některé prvotní částice se spojují silnými interakcemi, aby vznikly atomy. Toto je jednotka, která definuje chemické prvky a celou periodickou tabulku. Atomy jsou v zásadě tvořeny protony, neutrony a elektrony. Na následujícím obrázku vidíte vyobrazení atomu s protony a neutrony v jádru a elektrony vně:

Protony jsou odpovědné za kladný náboj jádra, které spolu s neutrony tvoří téměř celou hmotnost atomu. Na druhé straně jsou elektrony zodpovědné za záporný náboj atomu rozptýlený kolem jádra v elektronicky hustých oblastech zvaných orbitály..
Atomy se od sebe liší počtem protonů, neutronů a elektronů, které mají. Protony však definují atomové číslo (Z), které je zase charakteristické pro každý chemický prvek. Všechny prvky tedy mají různá množství protonů a jejich pořadí lze vidět v rostoucím pořadí v periodické tabulce..
Molekulární úroveň
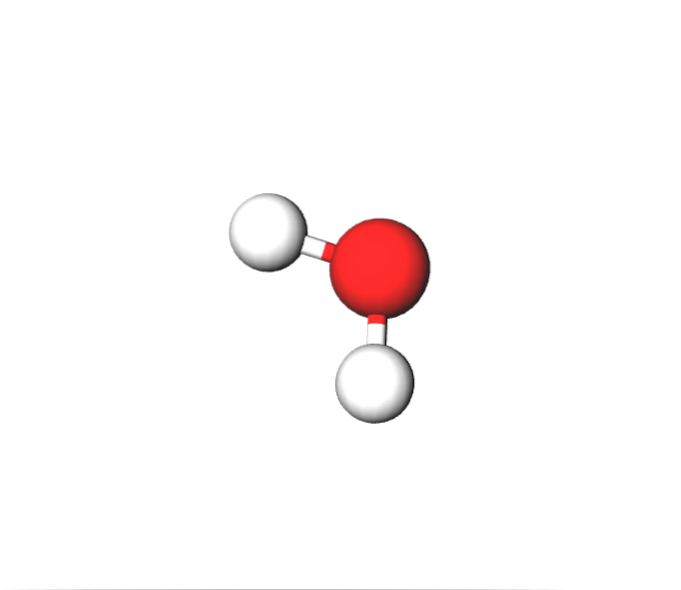
Na molekulární úrovni vstupujeme do oblasti chemie, fyzikálně-chemické a trochu vzdálenější farmacie (syntéza léčiv).
Atomy jsou schopné vzájemné interakce prostřednictvím chemické vazby. Když je tato vazba kovalentní, to znamená s co nejspravedlivějším sdílením elektronů, říká se, že se atomy spojily, aby vznikly molekuly.
Na druhou stranu mohou atomy kovů interagovat pomocí kovové vazby, aniž by definovaly molekuly; ale ano krystaly.
Pokračováním v krystalech mohou atomy ztratit nebo získat elektrony, aby se staly kationty nebo anionty. Tito dva tvoří duo známé jako ionty. Podobně mohou některé molekuly nabývat elektrické náboje, které se nazývají molekulární nebo polyatomové ionty..
Z iontů a jejich krystalů, jejich obrovského množství, se rodí minerály, které tvoří a obohacují zemskou kůru a plášť.
V závislosti na počtu kovalentních vazeb jsou některé molekuly masivnější než jiné. Když tyto molekuly mají opakující se strukturní jednotku (monomer), říká se o nich, že jsou makromolekuly. Mezi nimi například máme proteiny, enzymy, polysacharidy, fosfolipidy, nukleové kyseliny, umělé polymery, asfaltény atd..
Je nutné zdůraznit, že ne všechny makromolekuly jsou polymery; ale všechny polymery jsou makromolekuly.
Stále na molekulární úrovni se mohou molekuly a makromolekuly agregovat prostřednictvím Van der Wallsových interakcí za vzniku konglomerátů nebo komplexů nazývaných supramolekuly. Mezi nejznámější patří micely, vezikuly a dvouvrstvá lipidová stěna.
Supramolekuly mohou mít velikosti a molekulové hmotnosti menší nebo větší než makromolekuly; Jejich nekovalentní interakce jsou však strukturálními základy nesčetných biologických, organických a anorganických systémů..
Úroveň buněčných organel
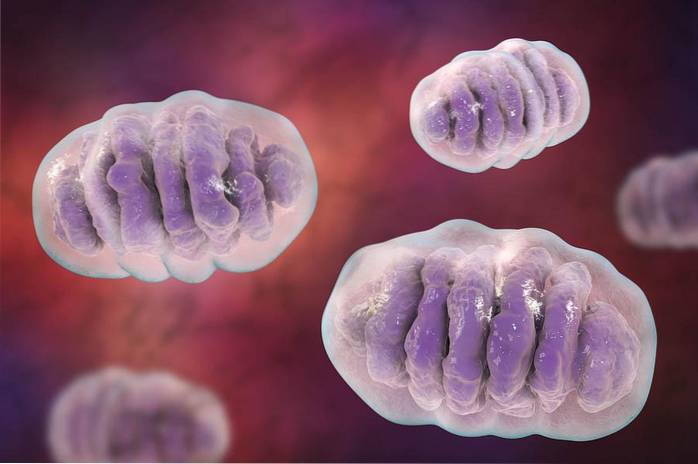
Supramolekuly se liší svou chemickou povahou, a proto spolu navzájem charakteristickým způsobem koexistují, aby se přizpůsobily prostředí, které je obklopuje (v případě buněk vodné)..
Tehdy se objevují různé organely (mitochondrie, ribozomy, jádro, Golgiho aparát atd.), Z nichž každá má plnit specifickou funkci v kolosální živé továrně, kterou známe jako buňku (eukaryotickou a prokaryotickou): „atom“ život.
Úroveň buňky
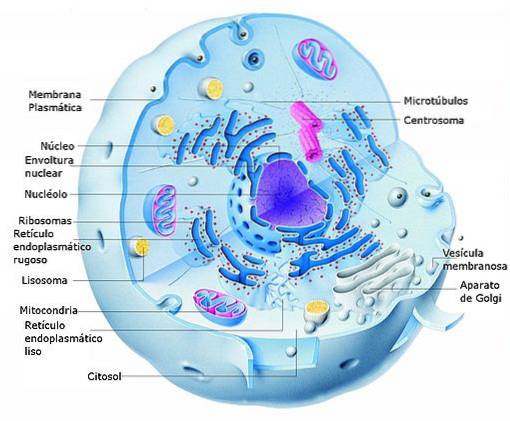
Na buněčné úrovni vstupuje do hry biologie a biochemie (kromě dalších souvisejících věd). V těle existuje klasifikace pro buňky (erytrocyty, leukocyty, spermie, vajíčka, osteocyty, neurony atd.). Buňku lze definovat jako základní jednotku života a existují dva hlavní typy: eukaryoty a prokatioty.
Mnohobuněčná úroveň
Rozlišující sady buněk definují tkáně, tyto tkáně vytvářejí orgány (srdce, slinivka, játra, střeva, mozek) a nakonec orgány integrují různé fyziologické systémy (dýchací, oběhový, trávicí, nervový, endokrinní atd.). Toto je mnohobuněčná úroveň. Srdce tvoří například sada tisíců buněk:
Již v této fázi je obtížné studovat jevy z molekulárního hlediska; ačkoli farmacie, supramolekulární chemie zaměřená na medicínu a molekulární biologie, zachovávají tuto perspektivu a přijímají takové výzvy.
Organismy

V závislosti na typu buňky, DNA a genetických faktorech buňky nakonec vytvářejí organismy (rostlinné nebo zvířecí), z nichž jsme již zmínili člověka. Toto je odrazový můstek života, jehož složitost a rozlehlost je i dnes nepředstavitelná. Například tygr je považován za pandu za organismus.
Úroveň populace

Organismy reagují na podmínky prostředí a přizpůsobují se vytvářením populací k přežití. Každá populace je studována jedním z mnoha oborů přírodních věd a také komunitami, které z nich pocházejí. Máme hmyz, savce, ptáky, ryby, řasy, obojživelníky, pavoukovce, chobotnice a mnoho dalších. Například sada motýlů tvoří populaci.
Ekosystém

Ekosystém zahrnuje vztahy mezi biotickými faktory (které mají život) a abiotickými faktory (neživot). Skládá se ze společenství různých druhů, které sdílejí stejné místo k životu (stanoviště) a které k přežití používají abiotické složky.
Voda, vzduch a půda (minerály a horniny), definujte abiotické složky („bez života“). Mezitím jsou biotické složky tvořeny všemi živými bytostmi v celém jejich vyjádření a porozumění, od bakterií po slony a velryby, které interagují s vodou (hydrosféra), vzduchem (atmosféra) nebo půdou (litosféra)..
Soubor ekosystémů celé Země tvoří další úroveň; biosféra.
Biosféra
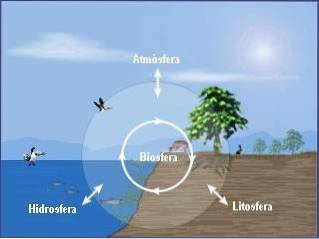
Biosféra je úroveň složená ze všech živých bytostí žijících na planetě a jejich stanovišť.
Po krátkém návratu na molekulární úroveň mohou samotné molekuly skládat směsi přemrštěných rozměrů. Oceány jsou například tvořeny molekulou vody HdvaO. Atmosféru zase tvoří plynné molekuly a vzácné plyny.
Všechny planety vhodné pro život mají svou vlastní biosféru; ačkoli atom uhlíku a jeho vazby jsou nutně jeho základy, bez ohledu na to, jak se vyvinuli jeho tvorové.
Pokud chceme pokračovat ve vzestupu rozsahu hmoty, konečně bychom vstoupili do výšek astronomie (planety, hvězdy, bílí trpaslíci, mlhoviny, černé díry, galaxie).
Reference
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Susana G. Morales Vargas. (2014). Úrovně organizace hmoty. Obnoveno z: uaeh.edu.mx
- Tania. (4. listopadu 2018). Úroveň organizace hmoty. Obnoveno z: scientskeptic.com
- Nápověda. (2019). Jaké jsou úrovně organizace hmoty? Obnoveno z: apuntesparaestudiar.com



Zatím žádné komentáře