
Jednoduchý proces destilace a příklady
The jednoduchá destilace je postup, při kterém se páry vyrobené z kapaliny odvádějí přímo do kondenzátoru, ve kterém teplota par klesá a dochází k jejich kondenzaci.
Používá se k oddělení těkavé složky od netěkavých složek přítomných v kapalině. Používá se také k oddělení dvou kapalin přítomných v roztoku s velmi odlišnými teplotami varu..
Jednoduchá destilace není účinná metoda pro oddělení dvou těkavých kapalin přítomných v roztoku. Když se jeho teplota zvyšuje dodávkou tepla, zvyšuje se také kinetická energie molekul, což jim umožňuje překonat kohezní sílu mezi nimi..
Těkavé kapaliny začínají vřít, když se jejich tlak par rovná vnějšímu tlaku vyvíjenému na povrch roztoku. Obě kapaliny přispívají ke složení vytvořené páry, přičemž těkavější kapalina je větší; tj. s nejnižším bodem varu.
Těkavější kapalina proto tvoří většinu vytvořeného destilátu. Proces se opakuje, dokud se nedosáhne požadované čistoty nebo nejvyšší možné koncentrace..
Rejstřík článků
- 1 Jednoduchý proces destilace
- 1.1 Zařízení
- 1.2 Kondenzátor
- 1.3 Topení
- 2 Příklady
- 2.1 Destilace vody a alkoholu
- 2.2 Separace kapalina-pevná látka
- 2.3 Alkohol a glycerin
- 3 Odkazy
Jednoduchý proces destilace
Při jednoduché destilaci se teplota roztoku zvyšuje až do varu. V tu chvíli nastává přechod mezi kapalným a plynným stavem. To je pozorováno, když v roztoku začne konstantní probublávání.
tým
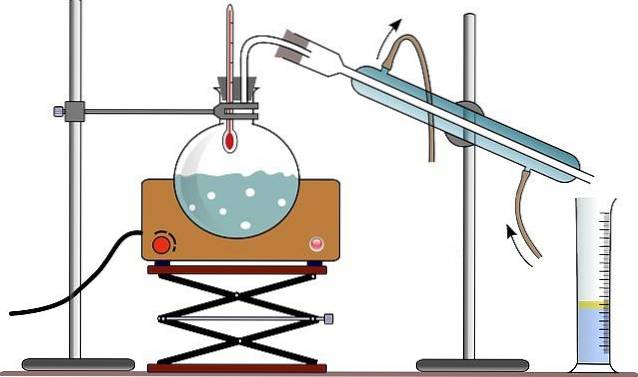
Zařízení pro jednoduchou destilaci obvykle sestává z hořáku nebo topné pokrývky (viz obrázek); kulatá žárovzdorná skleněná baňka s vybroušeným skleněným ústím, aby se umožnilo její spojení; a některé skleněné korálky (některé používají dřevěnou tyčinku) ke zmenšení velikosti vytvořených bublin.
Skleněné kuličky slouží jako jádra vytvářející bubliny, která umožňují kapalině pomalu vařit a nedochází k přehřátí, které má za následek vznik jakýchsi obřích bublin; schopné dokonce vytlačit z destilační baňky množství kapaliny.
K ústí baňky je připevněn žárovzdorný skleněný adaptér se třemi ústy, která jsou vyrobena z broušeného skla. Jedno hrdlo je připojeno k destilační baňce, druhé hrdlo je připojeno ke kondenzátoru a třetí hrdlo je uzavřeno pomocí gumové zátky..
Na obrázku držák postrádá tento adaptér; a místo toho jsou přes stejnou gumovou zátku umístěny teploměr a přímý konektor ke kondenzátoru.
Kondenzátor
Kondenzátor je zařízení určené k plnění funkce, kterou naznačuje jeho název: ke kondenzaci páry, která jím prochází. Svým horním hrdlem je spojen s adaptérem a spodním hrdlem je připojen k balónu, kde se shromažďují destilační produkty..
V případě obrázku používají (i když to není vždy správné) odměrný válec k měření destilovaného objemu najednou.
Voda, která cirkuluje vnějším pláštěm kondenzátoru, vstupuje do něj spodní částí a vystupuje horní částí. Tím je zajištěno, že teplota kondenzátoru je dostatečně nízká, aby umožnila kondenzaci par produkovaných v destilační baňce..
Všechny části, které tvoří destilační aparát, jsou upevněny svorkami spojenými s kovovým nosičem.
Objem roztoku, který má být podroben destilaci, se umístí do kulaté baňky s vhodnou kapacitou.
Správné připojení se provádí pomocí grafitu nebo maziva, aby se zajistilo účinné utěsnění, a zahřívání roztoku začíná. Současně začíná průchod vody kondenzátorem.
Topení
Jak se destilační baňka zahřívá, je na teploměru pozorováno zvýšení teploty, dokud není dosaženo bodu, kdy teplota zůstává konstantní. To zůstane tak, i když topení pokračuje; pokud se veškerá těkavá kapalina zcela neodpařila.
Vysvětlení tohoto chování spočívá v tom, že bylo dosaženo bodu varu složky s nejnižší teplotou varu kapalné směsi, při níž se její tlak par rovná vnějšímu tlaku (760 mm Hg).
V tomto okamžiku je veškerá tepelná energie vynaložena na změnu z kapalného stavu do plynného stavu, která zahrnuje vypršení mezimolekulární kohezní síly kapaliny. Dodávka tepla se tedy neprojeví zvýšením teploty..
Kapalný produkt z destilace se shromažďuje ve správně označených baňkách, jejichž objemy budou záviset na objemu původně umístěném v destilační baňce..
Příklady
Destilace vody a alkoholu
Máte 50% roztok alkoholu ve vodě. Věděli jsme, že bod varu alkoholu je 78,4 ° C a bod varu vody je přibližně 100 ° C, lze tedy čistý alkohol získat jednoduchým destilačním krokem? Odpověď je ne.
Zahřátím směsi alkoholu a vody se zpočátku dosáhne bodu varu nejvíce těkavé kapaliny; v tomto případě alkohol. Vytvořená pára bude mít vyšší podíl alkoholu, ale bude také vysoká přítomnost vody v páře, protože teploty varu jsou podobné..
Kapalina shromážděná z destilace a kondenzace bude mít obsah alkoholu vyšší než 50%. Pokud je tato kapalina podrobena postupné destilaci, lze dosáhnout koncentrovaného alkoholového roztoku; ale ne čisté, protože páry budou i nadále táhnout vodu do určitého složení a vytvářet takzvaný azeotrop
Kapalný produkt z fermentace cukrů má obsah alkoholu 10%. Tuto koncentraci lze jednoduchou destilací zvýšit na 50%, jako v případě whisky.
Separace kapalina-pevná látka
Roztok soli ve vodě se skládá z kapaliny, kterou lze těkat, a netěkavé sloučeniny s vysokou teplotou varu: soli..
Destilací roztoku lze v kondenzační kapalině získat čistou vodu. Mezitím se na dně destilační baňky usadí soli.
Alkohol a glycerin
Existuje směs ethylalkoholu s bodem varu 78,4 ° C a glycerinu s bodem varu 260 ° C. Když se podrobí jednoduché destilaci, bude mít vytvořená pára velmi vysoké procento alkoholu, téměř 100%..
Proto bude destilovaná kapalina získána s určitým procentem alkoholu, podobně jako u páry. Stává se to proto, že teploty varu kapalin jsou velmi odlišné.
Reference
- Claude Yoder. (2019). Destilace. Drátová chemie. Obnoveno z: wiredchemist.com
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Dragani, Rachelle. (17. května 2018). Tři příklady jednoduchých destilačních směsí. Vědění. Obnoveno z: sciencing.com
- Helmenstine, Anne Marie, Ph.D. (2. ledna 2019). Co je to destilace? Definice chemie. Obnoveno z: thoughtco.com
- Dr. Welder. (s.f.). Jednoduchá destilace. Obnoveno z: dartmouth.edu
- University of Barcelona. (s.f.). Destilace. Obnoveno z: ub.edu



Zatím žádné komentáře