
Struktura kyseliny sulfonové, názvosloví, vlastnosti, použití

To se nazývá kyselina sulfonová jakákoli sloučenina patřící do rodiny organických kyselin, která má jednu nebo více skupin -SO3H. Někteří autoři naznačují, že mateřskou sloučeninou je H-S (= O)dva-OH nebo H-SO3H, nazývaný nějakou „kyselinou sulfonovou“, však jeho existence nebyla prokázána, ani jeho tautomer HO-S (= O) -OH známý jako „kyselina sírová“ (HdvaSW3), ani v roztoku, ani v pevném stavu.
To je způsobeno skutečností, že plynný oxid siřičitý (IV) (SOdva) ve vodném roztoku se převede na hydrogensiřičitanové ionty (HSO3-) a pyrosulfit (S.dvaNEBO5dva-) a ne H-S (= O)dva-OH ani HO-S (= O) -OH, což již bylo ověřeno mnoha chemickými vědci.
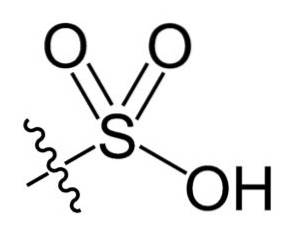
V chemickém vzorci R-SO3H sulfonových kyselin, skupina R může představovat uhlovodíkové skelety, jako je alkan, alken, alkyn a / nebo aren. Ty mohou mimo jiné obsahovat sekundární funkční skupiny, jako jsou esterové, etherové, ketonové, amino, amido, hydroxylové, karboxylové a fenolové skupiny..
Kyseliny sulfonové jsou silné kyseliny srovnatelné s kyselinou sírovou (HdvaSW4). Zbytek jeho vlastností však do značné míry závisí na povaze skupiny R..
Některé mají tendenci desulfonovat při vysokých teplotách. To znamená ztrátu skupiny -SO3H, zvláště když R je aren, tj. S benzenovým kruhem.
Sulfonové kyseliny mají mnoho použití v závislosti na jejich chemickém vzorci. Používají se k výrobě barviv, inkoustů, polymerů, detergentů, povrchově aktivních látek a jako katalyzátory, mezi mnoha jinými aplikacemi..
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Vlastnosti
- 4 Získání
- 4.1 Kyseliny arylsulfonové
- 4.2 Alkylsulfonové kyseliny
- 5 použití
- 5.1 Kyseliny sulfonové pro povrchově aktivní látky a detergenty
- 5.2 Barviva na bázi sulfonových kyselin
- 5.3 Amidy na bázi sulfonových kyselin
- 5.4 Fluorované a chlorfluorované sulfonové kyseliny
- 5.5 V biologických aplikacích
- 5.6 V ropném průmyslu
- 5.7 Ve složení maziv a antikorozních látek
- 6 Reference
Struktura
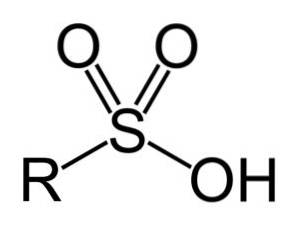
Kyseliny sulfonové mají následující obecnou strukturu:
Nomenklatura
- Sulfonylová skupina: -SO3H
- Alkylová nebo arylsulfonová kyselina: R-SO3H
Vlastnosti
Jsou pevné nebo kapalné v závislosti na skupině R. Plynné sulfonové kyseliny nejsou známy.
Jejich fyzikální a chemické vlastnosti závisí na povaze skupiny R. Pro srovnání jsou uvedeny některé fyzikální vlastnosti různých sulfonových kyselin, kde t.t. je teplota tání a např. je bod varu při tlaku 1 mm Hg:
- Kyselina methansulfonová: t.t. 20 ° C; např. 122 ° C
- Kyselina ethansulfonová: t.t. -17 ° C; např. 123 ° C
- Kyselina propansulfonová: t.t. -37 ° C; např. 159 ° C
- Kyselina butansulfonová: t.t. -15 ° C; např. 149 ° C
- Kyselina pentansulfonová: t.t. -16 ° C; např. 163 ° C
- Kyselina hexansulfonová: t.t. 16 ° C; např. 174 ° C
- Kyselina benzensulfonová: t.t. 44 ° C; např. 172 ° C (při 0,1 mm Hg)
- Kyselina P-toluensulfonová: t.t. 106 ° C; např. 182 ° C (při 0,1 mm Hg)
- Kyselina 1-naftalensulfonová: t.t. 78 ° C; např. Rozkládá se
- Kyselina 2-naftalensulfonová: t.t. 91 ° C; např. Rozkládá se
- Kyselina trifluormethansulfonová: t.t. žádný; např. 162 ° C (při 760 mm Hg)
Většina z nich je velmi snadno rozpustná ve vodě.
Sulfonové kyseliny jsou ještě kyselější než karboxylové kyseliny. Mají kyselost podobnou kyselosti jako kyselina sírová. Rozpustí se ve vodném hydroxidu sodném a vodném hydrogenuhličitanu.
Mají sklon k tepelnému rozkladu, který způsobuje jejich desulfonaci. Některé z alkansulfonových kyselin jsou však tepelně stabilní. Zejména kyselina triflová nebo kyselina trifluormethansulfonová je jednou z nejsilnějších a nejstabilnějších kyselin.
Získávání
Kyseliny arylsulfonové
Arylsulfonové kyseliny se obvykle získávají sulfonačním procesem, který spočívá v přidání přebytku dýmavé kyseliny sírové (HdvaSW4 + SW3) na organickou sloučeninu, kterou chceme sulfonovat. Například v případě benzenu:
C6H6 + HdvaSW4 <-> C6H5SW3H + HdvaNEBO
ArH + HdvaSW4 <-> ArSO3H + HdvaNEBO
Sulfonace je reverzibilní reakce, protože když přidáme zředěnou kyselinu do kyseliny benzensulfonové a necháme směs projít párou, dojde k eliminační reakci SO.3 a benzen se destiluje odpařováním parou, čímž se rovnováha posune směrem k desulfonaci.
Sulfonačním činidlem může být také kyselina chlorsírová, kyselina sulfamová nebo ionty siřičitanu..
Alkylsulfonové kyseliny
Obvykle se připravují sulfooxidací, tj. Zpracováním alkylových sloučenin oxidem siřičitýmdva a kyslík Odva, nebo přímo s oxidem sírovým SO3.
RH + 2SOdva + NEBOdva + HdvaNEBO <--> R-SO3H + HdvaSW4
Aplikace
Kyseliny sulfonové pro povrchově aktivní látky a detergenty
Alkylbenzensulfonové kyseliny se používají při výrobě detergentů, což je jedno z nejrozšířenějších použití.
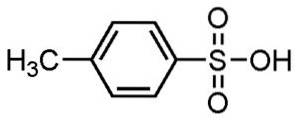
Používá se na práškové a tekuté prací prostředky, lehké nebo těžké prací prostředky, ruční mýdla a šampony.
Aktivními složkami jsou obecně lineární alkylbenzensulfonáty a sulfonované mastné estery..
Běžnými povrchově aktivními látkami jsou alfa-olefinsulfonáty, sulfobetainy, sulfosukcináty a alkyldifenyletherdisulfonáty, které jsou všechny odvozeny od sulfonových kyselin..
Tyto povrchově aktivní látky nacházejí použití v čisticích prostředcích pro domácnost, kosmetice, polymerizaci emulzí a výrobě zemědělských chemikálií..
Lignosulfonáty jsou sulfonované deriváty ligninu, složky dřeva, a používají se jako dispergační činidla, smáčedla, pojiva na vozovce, přísady do betonu a přísady do krmiva pro zvířata..
Derivát kyseliny 2-naftalensulfonové se používá ke zvýšení tekutosti a pevnosti cementu..
Barviva na bázi kyseliny sulfonové
Ty se obecně vyznačují tím, že obsahují azoskupiny (R-N = N-R).
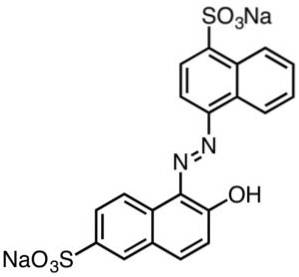
Barviva odvozená od sulfonových kyselin jsou užitečná v papírenském průmyslu, inkousty jako inkoustový tisk, textilie jako bavlna a vlna, kosmetika, mýdla, čisticí prostředky, potraviny a kůže..
Derivát kyseliny 2-naftalensulfonové se také používá jako přísada do barviv pro polyesterová vlákna a pro činění kůže..
Amidy na bázi kyseliny sulfonové
V této aplikaci vynikají kyseliny akrylamidosulfonové, které se používají v polymerech, při elektrolytickém nanášení kovů, jako povrchově aktivní látky a v průhledných povlacích proti zamlžování..
Používají se také při zvýšené regeneraci oleje, jako činidla uvolňující špínu, v hydraulických cementových směsích a jako urychlovače vytvrzování aminoplastové pryskyřice..
Některé sulfonamidy se také používají v insekticidních přípravcích.
Fluorované a chlorfluorované sulfonové kyseliny
V této skupině kyselina trifluormethansulfonová (CF3SW3H), nazývaná také kyselina triflová. Tato sloučenina má uplatnění v organické syntéze a katalýze polymeračních reakcí.
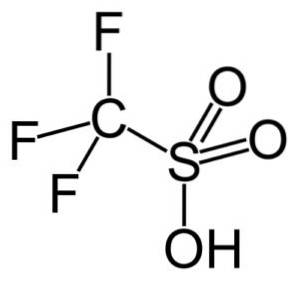
Například se používá při polymeraci aromatických olefinů a při přípravě vysoce rozvětvených parafinických uhlovodíků s vysokým oktanovým číslem pro použití jako přísady do paliva..
Další z jeho aplikací je při syntéze vodivých polymerů dopováním polyacetylenu, při výrobě například polovodičových typů p.
Kyselina pentafluorethansulfonová (CF3CFdvaSW3H), známá jako kyselina pentafilní, se používá jako organický katalyzátor.
Kyselina triflová reaguje s pentafluoridem antimonitým (SbF5) za vzniku takzvané „magické kyseliny“, superkyselinového katalyzátoru, který slouží k alkylaci a polymeraci.
Nafion-H je iontoměničová pryskyřice z perfluorované polymerní kyseliny sulfonové. Má tu vlastnost, že je inertní vůči silným kyselinám, silným zásadám a redukčním nebo oxidačním činidlům..
V biologických aplikacích
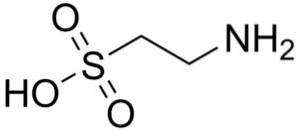
Jednou z mála sulfonových kyselin vyskytujících se v přírodě je 2-aminoethansulfonová kyselina, lépe známá jako taurin, esenciální aminokyselina zejména pro kočky.
Syntetický a přírodní taurin se používají jako doplňky do krmiv pro zvířata v zájmovém chovu a farmaceutik..
Kyselina taurocholová je složkou žluči a podílí se na trávení tuků. Kyselina 8-anilino-1-naftalensulfonová, syntetická sloučenina, se používá při studiu proteinů.
Kopolymery močoviny a kyseliny bifenyldisulfonové se používají jako inhibitory viru herpes simplex.
Některé deriváty sulfonových kyselin, jako je sulfonovaný polystyren a některé azosloučeniny, vykazují inhibiční vlastnosti viru lidské imunodeficience nebo HIV, aniž by byly nadměrně toxické vůči hostitelským buňkám..
V ropném průmyslu
Určité směsi ropných derivátů, které zahrnují různou kombinaci aromatických látek, parafinů a vícejaderných aromatických látek, mohou být sulfonovány a poté řádně neutralizovány za vzniku takzvaných ropných sulfonátů..
Tyto ropné sulfonáty mají tu vlastnost, že snižují povrchové napětí ropy ve vodě. Jeho výroba je navíc velmi nízká.
Z tohoto důvodu se do stávajících ropných vrtů injektují ropné sulfonáty, které pomáhají při těžbě ropy zachycené mezi horninami pod povrchem.
Ve složení maziv a antikorozních látek
Sulfonáty hořečnaté jsou široce používány ve formulacích maziv jako přísady dispergující detergenty a zabraňují opotřebení..
Sulfonáty barnatého se používají v mazačích pro valivá ložiska používaných ve vysokorychlostních aplikacích. Sulfonáty sodné a vápenaté mají použití v převodových mazivech a tucích pro zlepšení vlastností při extrémním tlaku.
Hořčíkové soli sulfonových kyselin jsou také užitečné v antikorozních aplikacích, jako jsou povlaky, tuky a pryskyřice..
Reference
- Falk, Michael a Giguere, Paul A. (1958). O povaze kyseliny siřičité. Canadian Journal of Chemistry, sv. 36, 1958. Obnoveno z nrcresearchpress.com
- Betts, R.H. a Voss, R.H. (1970). Kinetika výměny kyslíku mezi siřičitanovým iontem a vodou. Canadian Journal of Chemistry, sv. 48, 1970. Obnoveno z nrcresearchpress.com
- Bavlna, F.A. a Wilkinson, G. (1980). Pokročilá anorganická chemie. Čtvrté vydání. Kapitola 16. John Wiley & Sons.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Svazek 23. Čtvrté vydání. John Wiley & Sons.
- Kosswig, Kurt. (2012). Povrchově aktivní látky. Ullmann's Encyclopedia of Industrial Chemistry sv. 35. Wiley-VCH Verlag GmbH & Co..



Zatím žádné komentáře