
Vlastnosti, výroba, použití dvojchromanu sodného (Na2Cr2O7)

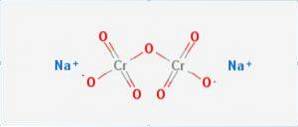
The dichroman sodný je to anorganická sloučenina vzorce Na2Cr2O7. Je to jedna z mnoha sloučenin šestimocného chrómu (Cr VI). Jeho struktura je znázorněna na obrázku 1, ačkoli se solí se obvykle zachází v dihydrátové formě, jejíž vzorec by byl Na2Cr2O7 · H2O..
Má dvě iontové vazby mezi molekulami sodíku a záporně nabitým kyslíkem. Chromová ruda se extrahuje z dichromanu sodného. Ročně se vyprodukují miliony kilogramů dichromanu sodného.
Čína je největším producentem dichromanu sodného, avšak čínské chemické závody mají relativně nízkou produkci, každý méně než 50 000 tun ročně, ve srovnání s kazašským závodem, který produkuje více než 100 000 tun ročně..
Rostliny v Rusku, Spojených státech a Velké Británii mají střední produkci mezi 50 000 a 100 000 tunami ročně (Kogel, 2006).
Pokud jde o reaktivitu a vzhled, má dichroman sodný podobné vlastnosti jako dichroman draselný, avšak sodná sůl je rozpustnější ve vodě a má nižší ekvivalentní hmotnost než draselná sůl..
Dichroman sodný vytváří při zahřátí toxické výpary chrómu. Je to silné oxidační činidlo a je vysoce korozivní.
Tuto sloučeninu lze nalézt ve zdrojích kontaminované pitné vody z různých průmyslových procesů, jako jsou galvanické nebo galvanické techniky, činění kůže a výroba textilu..
Rejstřík článků
- 1 Fyzikální a chemické vlastnosti
- 2 Výrobní metody
- 3 Reaktivita a nebezpečí
- 4 Použití a aplikace
- 5 Biochemie
- 6 Reference
Fyzikální a chemické vlastnosti
Dichroman sodný se skládá z krystalů s monoklinickou strukturou, které jsou v bezvodé formě bez zápachu červeno-oranžové barvy. Jeho molekulová hmotnost je 261,97 g / mol v bezvodé formě a 298,00 g / mol ve formě dihydrátu..
Má teplotu tání 356,7 stupňů Celsia, teplotu varu 400 stupňů Celsia, při které se rozkládá. Má hustotu 2,52 g / ml.

Vzhled dvojchromanu sodného je znázorněn na obrázku 2. Jeho rozpustnost ve vodě je 187 g na 100 gramů při 25 stupních Celsia a jeho rozpustnost v ethanolu je 513,2 gramů na litr při 19,4 stupních Celsia (National Center for Biotechnology Information, n.d.).
Je považována za stabilní sloučeninu, pokud je skladována za doporučených podmínek a není hořlavá. Jelikož se jedná o silné oxidační činidlo, je korozivní a v roztoku jde o kyselinu, která má schopnost snížit pH na 4 v 1% hmotn./obj. Roztoku..
Výrobní metody
Chroman sodný lze převést na dichroman kontinuálním procesem, který se zabývá kyselinou sírovou, oxidem uhličitým nebo kombinací těchto dvou látek..
Odpařením louhu dichromanu sodného dojde k vysrážení síranu sodného a / nebo hydrogenuhličitanu sodného a tyto sloučeniny se odstraní před konečnou krystalizací z dichromanu sodného..
Dichroman sodný lze vyrobit ve třech krocích:
- Podmínky oxidace alkalických pražených chromitů
- Loužení. Extrakce rozpustné hmoty ze směsi působením kapalného rozpouštědla
- Konverze monochromátu sodného na dichroman sodný pomocí kyseliny.
Bezvodý dichroman sodný lze připravit roztavením dihydrátu dichromanu sodného, krystalizací vodných roztoků dichromanu nad 86 ° C nebo sušením roztoků dichromanu sodného ve sprejových sušičkách..
Jako pohodlný a nákladově efektivní způsob přepravy množství se používají roztoky dvojchromanu sodného v koncentraci 69 a 70% w / v, aby se předešlo nutnosti ruční manipulace nebo rozpouštění krystalů..
Reaktivita a nebezpečí
Je to silné oxidační činidlo. Nekompatibilní se silnými kyselinami. Kontakt s hořlavými materiály může způsobit požár. Za tepla nebo ohně mohou vznikat toxické výpary oxidu chromitého.
Známá „směs kyseliny chromové“ dichromanu a kyseliny sírové s organickými zbytky vede k prudké exotermické reakci. Tato směs v kombinaci se zbytky acetonu také vede k prudké reakci..
Kombinace dichromanu a kyseliny sírové s alkoholy, ethanolem a 2-propanolem vede k prudké exotermické reakci. Vzhledem k tomu, že dochází k mnoha událostem zahrnujícím smíchání kyseliny dichroman-sírová s oxidovatelnými organickými materiály, je pravděpodobně nejlepší se těmto interakcím vyhnout..
Kombinace dichromanu s hydrazinem je výbušná, lze obecně očekávat intenzivní reakci dichromanu s aminy. Přidání dehydratované dichromanové soli k anhydridu kyseliny octové vede ke konečně výbušné exotermické reakci..
Bór, křemík a dichromany tvoří pyrotechnické směsi. Směs kyseliny octové, 2-methyl-2-pentenalu a dichromanu vede k nekontrolovatelné reakci (Chemical Datasheet Sodium Dichromate., 2016).
Vdechování prachu nebo mlhy způsobuje podráždění dýchacích cest, které někdy připomíná astma. Může dojít k perforaci septa. Je to považováno za jed.
Požití způsobuje zvracení, průjem a velmi neobvykle komplikace žaludku a ledvin. Kontakt s očima nebo kůží způsobuje místní podráždění. Opakovaná expozice kůže způsobuje dermatitidu.
Dichroman sodný je pro člověka karcinogenní. Existují důkazy, že šestimocný chrom nebo sloučeniny Cr (VI) mohou způsobit rakovinu plic u lidí. Bylo prokázáno, že dichroman sodný způsobuje rakovinu plic u zvířat.
Ačkoli nebyl dichroman sodný identifikován jako teratogenní nebo reprodukčně riziková sloučenina, je známo, že sloučeniny šestimocného chrómu nebo Cr (VI) jsou teratogeny a způsobují poškození reprodukce, jako je snížení plodnosti a interference s menstruačními cykly..
Dichroman sodný může způsobit poškození jater a ledvin, proto s ním musíte zacházet velmi opatrně (New Jersey Department of Health, 2009).
V případě požití by měl postižený vypít vodu nebo mléko; nikdy nevyvolávejte zvracení. V případě kontaktu s pokožkou nebo očima by mělo být zacházeno jako s popáleninami kyselinami; vypláchněte jim oči po dobu nejméně 15 minut vodou.
Vnější léze lze otřít 2% roztokem thiosíranu sodného. Ve všech případech by měl být konzultován lékař.
Použití a aplikace
Kromě svého významu při výrobě dalších chromových chemikálií má dichroman sodný také mnoho přímých použití jako přísada při výrobě:
- Kovová povrchová úprava: pomáhá odolávat korozi a čistit kovové povrchy, rovněž podporuje přilnavost barvy.
- Organické produkty: používají se jako oxidační činidla při výrobě produktů, jako je vitamin K a vosk.
- Pigmenty: používá se při výrobě anorganických chromanových pigmentů, kde produkuje řadu barev stabilních vůči světlu. Některé stupně chromanu se také používají jako inhibitory koroze v základních nátěrech a základních nátěrech..
- Keramika: používá se k přípravě barevného skla a keramických glazur.
- Textil: používá se jako mořidlo pro kyselá barviva ke zlepšení jejich rychlých barvicích vlastností.
- Výroba síranu chromitého.
(Dichroman sodný. Stavební kámen pro prakticky všechny ostatní sloučeniny chrómu., 2010–2012)
Dihydrát dichromanu sodného, ideální pro použití v různých podmínkách, včetně aplikací při vysokých teplotách, jako jsou keramické glazury a barevné sklo.
Oxid chromový, který je tvrdší než jiné oxidy kovů, jako je titan nebo železo, je ideální pro prostředí, kde jsou agresivní teploty a podmínky procesu.
Tato látka se používá hlavně k výrobě jiných sloučenin chrómu, ale také se používá v bentonitových kalech používaných při výrobě oleje, v ochranných prostředcích na dřevo, při výrobě organických chemikálií a jako inhibitor koroze..
Při smíchání s dvojchromanem draselno-hlinitým za použití tepelně hliníkového procesu produkuje oxid chromitý vysoce čistý kovový chrom. To je zásadní složka při výrobě vysoce výkonných slitin používaných v leteckém a kosmickém průmyslu..
V organické syntéze se dichroman sodný používá jako oxidační činidlo při oxidačních redukčních reakcích v přítomnosti kyseliny sírové..
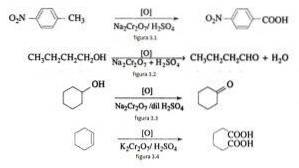
Například oxidace p-nitrotoluenu za vzniku p-nitrobenzoové kyseliny, při oxidaci n-butanolu za vzniku n-butaldehydu, při tvorbě cyklohexanonu z cyklohexanolu a při tvorbě kyseliny adipové, jak je znázorněno na obrázcích 3.1, 3.2, 3.3 a 3.4 (VK Ahluwalia, 2004).
Biochemie
Intratracheální instilace dichromanu sodného (CrVI) a hydroxidu chromitého (CrIII) u samců potkanů vedla ke zvýšeným koncentracím chromu v plné krvi, plazmě a moči po dobu až 72 hodin po expozici; Vrcholových koncentrací bylo dosaženo 6 hodin po expozici..
Poměr koncentrací chromu v plné krvi k koncentraci chromu v plazmě byl významně odlišný pro ošetření Cr (VI) a Cr (III). Pro hodnocení expozice chromu by se proto měly používat testy na chrom a plazmu..
Chrom byl také detekován v periferních lymfocytech. Cr (VI), ale ne Cr (III) se po léčbě významně akumuloval v lymfocytech. Tyto buňky mají potenciál být použity jako biomarkery při hodnocení expozice sloučeninám chrómu (Hooth, 2008).
Reference
- Chemický datový list Dichroman sodný. (2016). Obnoveno z cameo chemikálií: cameochemicals.noaa.
- Hooth, M. J. (2008). Technická zpráva o toxikologii a studiích karcinogeneze dihydrátu dichromanu sodného. National Institute of Health USA.
- Kogel, J. E. (2006). Industrial Minerals & Rocks: Commodities, Markets, and Uses Seventh Edition. littleton colorado: společnost pro těžbu, metalurgii a průzkum vč.
- Národní centrum pro biotechnologické informace. (s.f.). Složená databáze PubChem; CID = 25408. Citováno z pubchem.com: pubchem.ncbi.nlm.nih.gov.
- Ministerstvo zdravotnictví v New Jersey. (2009, listopad). informační list o nebezpečné látce dichroman sodný. Citováno z nj.gov: nj.gov.
- Dichroman sodný. Stavební kámen pro prakticky všechny ostatní sloučeniny chrómu. (2010-2012). Citováno z elementis chromium: elementischromium.com
- K. Ahluwalia, R. A. (2004). Komplexní praktická organická chemie: Přípravy a kvantitativní analýzy. Dillí: Univerzitní tisk (Indie).



Zatím žádné komentáře