
Části a příklady chemických rovnic

The chemická rovnice jedná se o schematické znázornění některých charakteristik chemické reakce. Lze také říci, že chemická rovnice popisuje změny, které zažívají různé látky zapojené do reakce.
Vzorce a symboly různých zúčastněných látek jsou umístěny v chemické rovnici, což jasně ukazuje počet atomů každého prvku přítomného ve sloučeninách, který se jeví jako dolní index a nelze jej změnit vyvážením rovnice.
Chemická rovnice musí vypadat vyváženě, to znamená, že počet atomů reaktantů i produktů musí být stejný. Tímto způsobem se dodržuje zákon zachování hmoty. Je žádoucí, aby čísla použitá při vyrovnávání rovnic byla celá čísla.
Tyto rovnice neodhalují po sobě jdoucí kroky ani to, jakými mechanismy se reaktanty transformují na produkty..
Proto, i když jsou velmi užitečné k pochopení toho, kam chemická reakce směřuje, neumožňuje pochopit její molekulární aspekty nebo to, jak je ovlivněna určitými proměnnými; jako je pH, viskozita, reakční doba, rychlost míchání a další.
Rejstřík článků
- 1 Části chemické rovnice
- 1.1 Umístění činidel a produktů
- 1.2 Vyvažování chemických rovnic
- 1.3 Fyzikální stavy složek chemické rovnice
- 1.4 Změny fyzikálního stavu
- 2 Příklad chemických rovnic
- 2.1 - Fotosyntéza
- 2.2 - Buněčné dýchání
- 2.3 - Reakce společných prvků
- 3 Odkazy
Části chemické rovnice
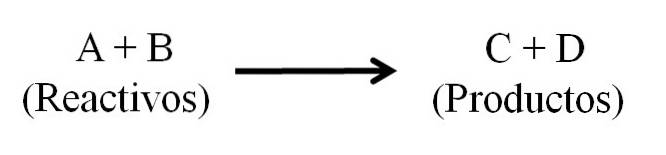
V zásadě existují tři hlavní části chemické rovnice: reaktanty, produkty a šipka označující směr chemické reakce..
Umístění činidel a produktů
Všechny látky, které fungují jako reaktanty, a všechny, které jsou produkty, se objevují v chemické rovnici. Tyto skupiny látek jsou odděleny šipkou, která označuje směr reakce. Reagencie jsou umístěny vlevo od šipky a produkty vpravo.
Šipka znamená, co se vyrábí a je orientováno zleva doprava (→), i když v reverzibilních reakcích existují dvě ekvivalentní a paralelní šipky; jeden směřoval doprava a druhý doleva. Symbol (Δ) je obvykle umístěn nad šipkou, což znamená, že při reakci bylo použito teplo..
Kromě toho je identifikace katalyzátoru obvykle umístěna na šipce, pokud možno s jeho vzorcem nebo symbolem. Různé látky, které se objevují jako reaktanty, jsou odděleny znaménkem (+), což znamená, že látky reagují nebo se navzájem kombinují.
V případě látek, které se objevují jako produkty, nemá znak (+) předchozí konotaci; pokud není reakce reverzibilní. Je vhodné, aby znaménko (+) bylo umístěno ve stejné vzdálenosti od látek, které odděluje.
Vyvažování chemických rovnic
Je základním požadavkem, aby chemické rovnice byly správně vyváženy. Za tímto účelem je umístěno číslo zvané stechiometrický koeficient. Kdykoli je to nutné, musí tento koeficient jít před látky, které se jeví jako reaktanty nebo produkty..
Tím je dosaženo toho, že počet všech atomů prvků, které se objevují jako reaktanty, je přesně stejný jako jejich počet, který se objeví v produktu. Nejjednodušší metodou vyvažování chemických rovnic je pokus a omyl..
Fyzikální stavy složek chemické rovnice
V některých chemických rovnicích je fyzikální stav látek označen indexem. K tomu se ve španělštině používají následující zkratky: (s) for solid state; l) pro kapalné skupenství; (g), plynný stav; a (ac), vodný roztok.
Příklad: reakce uhličitanu vápenatého s kyselinou chlorovodíkovou.
Zloděj3 (s) + 2 HCl(ac) → CaCl2 (s) + HdvaNEBO(l) + CO2 g)
Změny fyzického stavu
V některých případech je v chemické rovnici uvedeno, zda v chemické reakci dochází k produkci plynu nebo zda dochází k vysrážení některé z produkovaných látek.
Přítomnost plynu je indikována svislou šipkou, jejíž konec směřuje nahoru (↑), umístěný na pravé straně plynné látky.
Příklad: reakce zinku s kyselinou chlorovodíkovou.
Zn + 2 HCl → ZnCldva + Hdva↑
Pokud při chemické reakci jedna z látek vytvoří sraženinu, je to symbolizováno umístěním svislé šipky s jejím koncem směřujícím dolů (↓) umístěným na pravou stranu vysrážené látky..
Příklad: reakce kyseliny chlorovodíkové s dusičnanem stříbrným.
HCl + AgNO3 → HNO3 + AgCl ↓
Příklad chemických rovnic
- Fotosyntéza

Fotosyntéza je proces, při kterém rostliny zachycují a transformují světelnou energii přicházející ze slunečního světla, aby generovaly energii nezbytnou pro svoji existenci. Fotosyntézu provádějí některé organely rostlinných buněk zvané chloroplasty.
Thylakoidy se nacházejí v chloroplastové membráně, v místech, kde se nacházejí chlorofyly. na Y b, což jsou hlavní pigmenty, které zachycují světelnou energii.
I když je fotosyntéza složitý proces, lze ji nastínit v následující chemické rovnici:
6 COdva + 6 hdvaO → C.6H12NEBO6 + 6 O.dva↑ ΔGº = 2 870 kJ / mol
C6H12NEBO6 Je to vzorec pro glukózu, uhlohydrát metabolizovaný pro produkci ATP; sloučenina, která je hlavním zásobníkem energie ve většině živých věcí. Kromě toho je NADPH generován z glukózy, koenzymu nezbytného pro mnoho reakcí..
- Buněčné dýchání
Buňky využívají kyslík k metabolismu mnoha látek přítomných v požitém jídle. Mezitím se ATP používá jako zdroj energie pro činnosti prováděné živými bytostmi, které v těchto procesech produkují oxid uhličitý a vodu..
Pokud se jako model metabolizované látky použije glukóza, lze dýchání schematicky stanovit pomocí následující chemické rovnice:
C6H12NEBO6 + 6 O.dva → 6 COdva + 6 hdvaNEBO
- Reakce společných prvků
Rozkladná reakce
Sloučenina nebo sloučeniny disociují a tvoří s atomy další různé sloučeniny:
2 KClO3 (s) → 2 KCl(s) + 3 O.2 g)
Reakce posunutí
Kov reaguje se sloučeninou a nahrazuje v ní přítomný kov:
Mg(s) + KURS4 (ac) → Cu(s) + MgSO4 (ac)
Vylučovací reakce
V tomto typu reakce klesá počet atomů nebo skupin připojených k atomu uhlíku:
CH3-CHdvaBr + NaOH → HdvaC = CHdva + HdvaO + NaBr
Hydratační reakce
Jedná se o reakci, při které sloučenina přidává molekulu vody. Tato reakce je důležitá při přípravě alkoholů:
HdvaC = CHdva + HdvaO → HdvaC-CHdvaAch
Neutralizační reakce
Zásada nebo zásada reaguje s kyselinou za vzniku soli a vody:
HCl(ac) + NaOH(ac) → NaCl(ac) + HdvaNEBO(l)
Syntetická reakce
V tomto typu reakce se spojí dvě nebo více látek a vytvoří se nová sloučenina:
2 Li(s) + Cl2 g) → 2 LiCl(s)
Reakce dvojitého posunutí (metatéza)
V tomto typu reakce dochází k výměně pozitivních a negativních iontů za vzniku nových sloučenin:
AgNO3 (ac) + NaCl(ac) → AgCl(s) + Starší bratr3 (ac)
Reference
- Flores, J. (2002). Chemie. Vydání 1to bylo. Redakční Santillana
- Mathews, C. K., Van Holde, K. E. a Ahern, K. G. (2002). Biochemie. 3to bylo Edice. Vydavatel Pearson Addison Wesley
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Wikipedia. (2019). Chemická rovnice. Obnoveno z: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (20. září 2019). Co je chemická rovnice? Obnoveno z: thoughtco.com


Zatím žádné komentáře