
Vlastnosti chemických vazeb, způsob jejich vzniku, typy
The Chemická vazba je to síla, která dokáže držet pohromadě atomy, které tvoří hmotu. Každý typ hmoty má charakteristickou chemickou vazbu, která se skládá z účasti jednoho nebo více elektronů. Síly, které spojují atomy v plynech, se tedy liší například od kovů.
Všechny prvky periodické tabulky (s výjimkou helia a lehkých vzácných plynů) mohou mezi sebou vytvářet chemické vazby. Jejich povaha se však mění podle toho, z jakých prvků pocházejí elektrony, které je tvoří. Podstatným parametrem pro vysvětlení typu vazeb je elektronegativita.
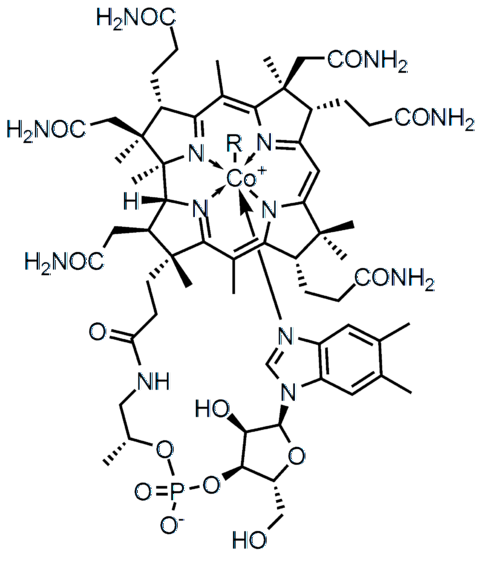
Rozdíl v elektronegativitě (ΔE) mezi dvěma atomy nedefinuje pouze typ chemické vazby, ale také fyzikálně-chemické vlastnosti sloučeniny. Soli se vyznačují tím, že mají iontové vazby (vysoké ΔE) a mnoho organických sloučenin, jako je vitamin B.12 (horní obrázek), kovalentní vazby (ΔE nízká).
Ve vyšší molekulární struktuře představuje každá z linií kovalentní vazbu. Klíny naznačují, že článek vychází z roviny (směrem ke čtečce) a podtržené za rovinou (směrem od čtečky). Všimněte si, že existují dvojné vazby (=) a atom kobaltu koordinovaný s pěti atomy dusíku a jedním postranním řetězcem R..
Ale proč se takové chemické vazby tvoří? Odpověď spočívá v energetické stabilitě zúčastněných atomů a elektronů. Tato stabilita musí vyvážit elektrostatické odpory, které zažívají mezi elektronovými mračny a jádry, a přitažlivost vyvíjenou jádrem na elektrony sousedního atomu..
Rejstřík článků
- 1 Definice chemické vazby
- 2 Funkce
- 3 Jak se tvoří chemické vazby?
- 3.1 Homonukleární sloučeniny A-A
- 3.2 Heteronukleární sloučeniny A-B
- 4 Druhy chemických vazeb
- 4.1 - Kovalentní vazba
- 4.2 - Iontová vazba
- 4.3 Kovová vazba
- 5 Příklady odkazů
- 6 Důležitost chemické vazby
- 7 Reference
Definice chemické vazby
Mnoho autorů uvedlo definice chemické vazby. Ze všeho nejdůležitějšího bylo to fyzikemchem G. N. Lewise, který definoval chemickou vazbu jako účast dvojice elektronů mezi dvěma atomy. Pokud atomy A a B mohou přispívat jediným elektronem, vytvoří se mezi nimi jednoduchá vazba A: B nebo A-B.
Před vytvořením vazby jsou obě A a B odděleny neurčitou vzdáleností, ale při vazbě je nyní síla, která je drží pohromadě v diatomické sloučenině AB a vzdálenost vazby (nebo délka).
Vlastnosti
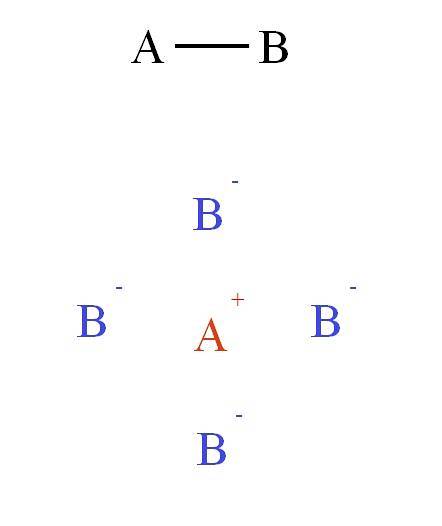
Jaké jsou vlastnosti této síly, která drží atomy pohromadě? Ty závisí více na typu spojení mezi A a B než na jejich elektronických strukturách. Například linka A-B je směrová. Co to znamená? Že síla vyvíjená spojením dvojice elektronů může být znázorněna na ose (jako by to byl válec).
Také toto pouto vyžaduje energii k rozbití. Toto množství energie lze vyjádřit v jednotkách kJ / mol nebo cal / mol. Jakmile bylo na sloučeninu AB aplikováno dostatek energie (například teplem), disociuje se na původní atomy A a B..
Čím stabilnější je vazba, tím více energie je zapotřebí k oddělení vázaných atomů..
Na druhou stranu, pokud by vazba ve sloučenině AB byla iontová, A+B-, pak by to byla nesměrová síla. Proč? Protože+ působí atraktivní silou na B- (a naopak), která závisí více na vzdálenosti, která odděluje oba ionty v prostoru, než na jejich relativní poloze.
Toto pole přitažlivosti a odpuzování spojuje další ionty a vytváří takzvanou krystalovou mřížku (horní obrázek: kation A+ leží obklopený čtyřmi anionty B-, a tyto čtyři kationty A+ a tak dále).
Jak se tvoří chemické vazby?
Homonukleární sloučeniny A-A
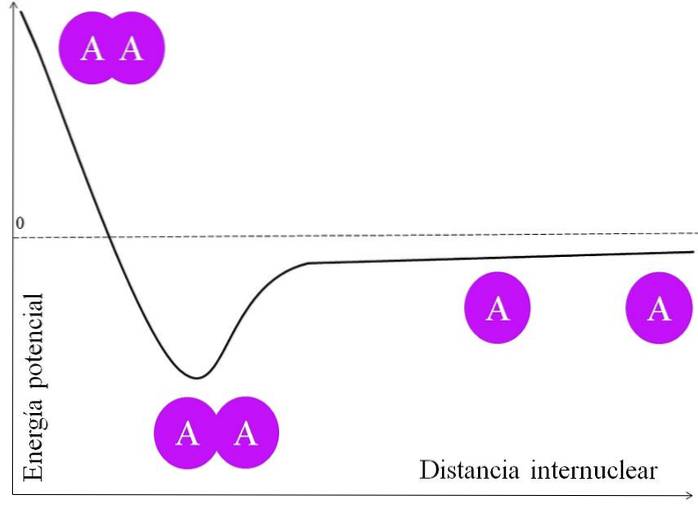
Aby dvojice elektronů vytvořila vazbu, je třeba nejprve zvážit mnoho věcí. Jádra, řekněme z A, mají protony, a proto jsou pozitivní. Jsou-li dva atomy A velmi daleko od sebe, tj. Ve velké mezijaderné vzdálenosti (horní obrázek), nezažijí žádnou přitažlivost.
Jak se dva atomy A přibližují ke svým jádrům, přitahují elektronový mrak sousedního atomu (fialový kruh). Toto je síla přitažlivosti (A na sousedním fialovém kruhu). Avšak dvě jádra A se navzájem odpuzují, protože jsou pozitivní, a tato síla zvyšuje potenciální energii vazby (vertikální osa).
Existuje mezijaderná vzdálenost, ve které potenciální energie dosahuje minima; to znamená, že jsou přitažlivé i odpudivé síly vyvážené (dva atomy A ve spodní části obrazu).
Pokud se tato vzdálenost po tomto bodě zmenší, vazba způsobí, že se obě jádra navzájem odpudí velkou silou, což destabilizuje sloučeninu A-A..
Aby se vazba vytvořila, musí existovat energeticky přiměřená mezijaderná vzdálenost; a dále se atomové orbitaly musí správně překrývat, aby se elektrony spojily.
Heteronukleární sloučeniny A-B
Co kdyby se místo dvou atomů A připojil jeden z A a druhý B? V tomto případě by se horní graf změnil, protože jeden z atomů by měl více protonů než druhý a elektronové mraky by měly různé velikosti..
Vzhledem k tomu, že vazba A-B se tvoří ve vhodné internukleární vzdálenosti, elektronový pár se nachází hlavně v blízkosti nejvíce elektronegativního atomu. To je případ všech heteronukleárních chemických sloučenin, které tvoří drtivou většinu těch, které jsou známé (a budou známy).
Ačkoli to není zmíněno do hloubky, existuje řada proměnných, které přímo ovlivňují přístup atomů a vznik chemických vazeb; některé jsou termodynamické (je reakce spontánní?), elektronické (jak úplné nebo prázdné jsou orbitaly atomů) a jiné kinetické.
Druhy chemických vazeb
Odkazy mají řadu charakteristik, které je navzájem odlišují. Několik z nich lze rozdělit do tří hlavních klasifikací: kovalentní, iontové nebo kovové.
Ačkoli existují sloučeniny, jejichž vazby patří k jednomu typu, mnohé se ve skutečnosti skládají ze směsi znaků každého z nich. Tato skutečnost je způsobena rozdílem v elektronegativitě mezi atomy, které tvoří vazby. Některé sloučeniny tedy mohou být kovalentní, ale ve svých vazbách mají určitý iontový charakter..
Stejně tak typ vazby, struktura a molekulová hmotnost jsou klíčové faktory, které definují makroskopické vlastnosti hmoty (jas, tvrdost, rozpustnost, teplota tání atd.).
-Kovalentní vazba
Kovalentní vazby jsou ty, které byly dosud vysvětleny. V nich se dva orbitaly (každý jeden elektron) musí překrývat s jádry oddělenými ve vhodné mezijaderné vzdálenosti..
Podle molekulární orbitální teorie (TOM), pokud je překrytí orbitalů frontální, vytvoří se vazba sigma σ (která se také nazývá jednoduchá nebo jednoduchá vazba). Zatímco pokud jsou orbitaly tvořeny bočními a kolmými přesahy vzhledem k mezijaderné ose, budeme mít vazby π (dvojité a trojité):
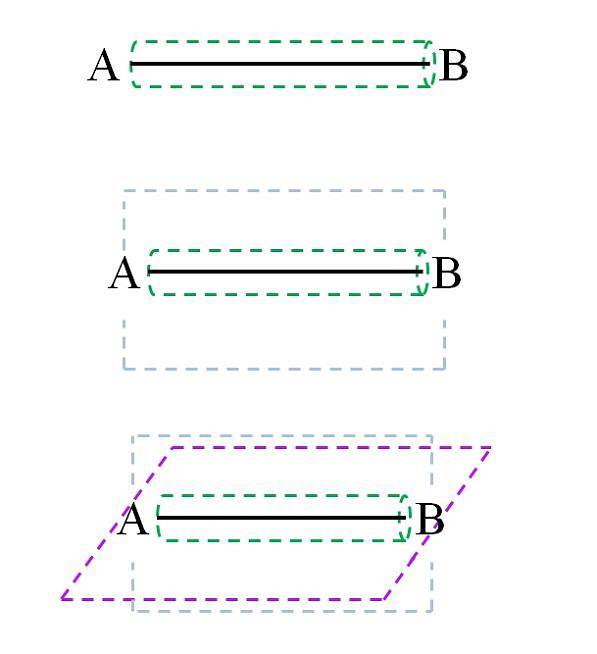
Jednoduchý odkaz
Σ vazba, jak je vidět na obrázku, je vytvořena podél mezijaderné osy. I když to není ukázáno, A a B mohou mít jiné vazby, a proto i svá vlastní chemická prostředí (různé části molekulární struktury). Tento typ článku se vyznačuje svou rotační silou (zelený válec) a tím, že je nejsilnější ze všech.
Například jednoduchá vazba v molekule vodíku se může otáčet na internukleární (H-H) ose. Podobně to dokáže hypotetická molekula CA-AB..
Odkazy C-A, A-A a A-B se otáčejí; ale pokud C nebo B jsou atomy nebo skupina objemných atomů, rotace A-A je stéricky bráněna (protože C a B by se srazily).
Jednoduché vazby se nacházejí prakticky ve všech molekulách. Jejich atomy mohou mít jakoukoli chemickou hybridizaci, pokud je překrytí jejich orbitalů frontální. Vraťme se zpět ke struktuře vitaminu B.12, jakýkoli jediný řádek (-) označuje jeden odkaz (například odkazy -CONHdva).
Dvojitý odkaz
Dvojitá vazba vyžaduje, aby atomy měly (obvykle) sp hybridizacidva. Čistá p vazba, kolmá ke třem hybridním sp orbitalůmdva, tvoří dvojnou vazbu, která vypadá jako šedivý list.
Všimněte si, že jak jednoduchá vazba (zelený válec), tak dvojná vazba (šedý list) existují současně. Na rozdíl od jednoduchých vazeb však dvojné vazby nemají stejnou svobodu otáčení kolem mezijaderné osy. Důvodem je to, že aby se článek (nebo fólie) mohl otáčet, musí se zlomit; proces, který potřebuje energii.
Rovněž vazba A = B je reaktivnější než A-B. Jeho délka je kratší a atomy A a B jsou v kratší mezijaderné vzdálenosti; proto existuje větší odpor mezi oběma jádry. Rozbití jednoduché i dvojné vazby vyžaduje více energie, než je potřeba k oddělení atomů v molekule A-B..
Ve struktuře vitaminu B.12 lze pozorovat několik dvojných vazeb: C = O, P = O a v aromatických kruzích.
Trojitá vazba
Trojitá vazba je ještě kratší než dvojná vazba a její rotace je energeticky narušena. V něm jsou vytvořeny dvě kolmé π vazby (šedé a fialové listy), stejně jako jednoduchá vazba.
Chemická hybridizace atomů A a B musí být obvykle sp: dva sp orbitaly vzdálené 180 ° a dva čisté p orbitaly kolmé k prvnímu. Všimněte si, že trojná vazba vypadá jako pádlo, ale bez rotační síly. Tuto vazbu lze vyjádřit jednoduše jako A≡B (N (N, molekula dusíku Ndva).
Ze všech kovalentních vazeb je to nejreaktivnější; ale zároveň ten, který potřebuje více energie pro úplné oddělení svých atomů (· A: +: B ·). Pokud vitamin B12 měl ve své molekulární struktuře trojnou vazbu, jeho farmakologický účinek by se drasticky změnil.
Šest elektronů se účastní trojných vazeb; ve čtyřech, čtyři elektrony; a v jednoduchém nebo jednoduchém, dva.
Tvorba jedné nebo více z těchto kovalentních vazeb závisí na elektronické dostupnosti atomů; to znamená, kolik elektronů potřebuje jejich orbitaly k získání oktetu valence.
Nepolární vazba
Kovalentní vazba se skládá ze stejného sdílení elektronového páru mezi dvěma atomy. To však platí striktně pouze v případě, že oba atomy mají stejnou elektronegativitu; tj. stejná tendence přitahovat elektronovou hustotu ze svého okolí do kompozitu.
Nepolární vazby jsou charakterizovány nulovým rozdílem elektronegativity (ΔE≈0). K tomu dochází ve dvou situacích: v homonukleární sloučenině (Adva), nebo pokud jsou chemická prostředí na obou stranách vazby rovnocenná (H3C-CH3, molekula etanu).
Příklady nepolárních vazeb lze vidět v následujících sloučeninách:
-Vodík (H-H)
-Kyslík (O = O)
-Dusík (N≡N)
-Fluor (F-F)
-Chlor (Cl-Cl)
-Acetylen (HC≡CH)
Polární vazby
Když je mezi oběma atomy výrazný rozdíl v elektronegativitě ΔE, vytvoří se podél osy vazby dipólový moment: Aδ+-Bδ-. V případě heteronukleární sloučeniny AB je B nejvíce elektronegativním atomem, a proto má vyšší elektronovou hustotu δ-; zatímco A, nejméně elektronegativní, má nedostatek náboje δ+.
Aby došlo k polárním vazbám, musí se spojit dva atomy s různou elektronegativitou; a tak tvoří heteronukleární sloučeniny. A-B připomíná magnet: má kladný a záporný pól. To mu umožňuje interakci s jinými molekulami prostřednictvím dipól-dipólových sil, mezi nimiž jsou vodíkové vazby..
Voda má dvě polární kovalentní vazby, H-O-H, a její molekulární geometrie je úhlová, což zvyšuje její dipólový moment. Pokud by jeho geometrie byla lineární, oceány by se vypařily a voda by měla nižší bod varu.
Skutečnost, že sloučenina má polární vazby, neznamená, že je polární. Například tetrachlormethan, CCl4, má čtyři polární vazby C-Cl, ale vzhledem k jejich čtyřbokému uspořádání končí dipólový moment vektorově anulovaný.
Datové nebo koordinační odkazy
Když se atom vzdá páru elektronů, aby vytvořil kovalentní vazbu s jiným atomem, mluvíme o dativní nebo koordinační vazbě. Například mít B: dostupný elektronový pár a A (nebo A+), což je elektronické neobsazené místo, je vytvořen odkaz B: A..
Ve struktuře vitaminu B.12 pět atomů dusíku je spojeno s kovovým středem Co tímto typem kovalentní vazby. Tyto dusíky se vzdávají svého volného elektronového páru kationtu.3+, koordinovat kov s nimi (Co3+: N-)
Další příklad lze najít v protonaci molekuly amoniaku za vzniku amoniaku:
H3N: + H+ => NH4+
Všimněte si, že v obou případech je to atom dusíku, který přispívá elektrony; proto dativní nebo koordinační kovalentní vazba nastává, když atom sám přispívá dvojicí elektronů.
Stejným způsobem může být molekula vody protonována, aby se stala hydroniovým (nebo oxoniovým) kationem:
HdvaO + H+ => H3NEBO+
Na rozdíl od amonného kationu má hydronium stále volný elektronový pár (H3NEBO:+); je však velmi obtížné přijmout další proton za vzniku nestabilního hydroniového dikátu, H4NEBOdva+.
-Iontová vazba

Na snímku je bílý kopec soli. Soli se vyznačují tím, že mají krystalické struktury, to znamená symetrické a uspořádané; vysoké teploty tání a varu, vysoké elektrické vodivosti při tání nebo rozpouštění a také jeho ionty jsou silně vázány elektrostatickými interakcemi.
Tyto interakce tvoří to, co je známé jako iontová vazba. Na druhém obrázku byl zobrazen kation A.+ obklopený čtyřmi anionty B-, ale toto je 2D reprezentace. Ve třech rozměrech, A+ by měl mít další anionty B- dopředu a za rovinu, tvořící různé struktury.
Tak, A+ může mít šest, osm nebo dokonce dvanáct sousedů. Počet sousedů obklopujících iont v krystalu je znám jako koordinační číslo (N.C). Pro každý N.C je přidružen typ krystalického uspořádání, které zase tvoří pevnou fázi soli.
Symetrické a fazetované krystaly viděné v solích jsou způsobeny rovnováhou vytvořenou interakcemi přitažlivosti (A+ B-) a odpuzování (A+ NA+, B- B-) elektrostatický.
Výcvik
Ale proč A + a B.-, nebo Na+ a Cl-, netvoří kovalentní vazby Na-Cl? Protože atom chloru je mnohem elektronegativnější než kov sodný, který se také vyznačuje tím, že se velmi snadno vzdává svých elektronů. Když se tyto prvky setkají, reagují exotermicky za vzniku stolní soli:
2Na (s) + Cldva(g) => 2NaCl (s)
Dva atomy sodíku se vzdají svého jednovalenčního elektronu (Na) na rozsivkovou molekulu Cldva, za vzniku Cl aniontů-.
Interakce mezi sodnými kationty a chloridovými anionty, i když představují slabší vazbu než kovalentní, jsou schopny udržet je silně spojené v pevné látce; a tato skutečnost se odráží ve vysoké teplotě tání soli (801 ° C).
Kovová vazba

Poslední z typů chemických vazeb je kovový. To lze nalézt na jakémkoli kovovém nebo slitinovém dílu. Vyznačuje se tím, že je zvláštní a liší se od ostatních, protože elektrony neprocházejí z jednoho atomu na druhý, ale spíše cestují jako moře skrz krystaly kovů.
Kovové atomy, řekněme měď, tedy vzájemně mísí své valenční orbitaly a vytvářejí vodivé pásy; skrz které elektrony (s, p, d nebo f) procházejí kolem atomů a drží je pevně pohromadě.
V závislosti na počtu elektronů, které procházejí kovovým krystalem, orbitálech poskytovaných pásmům a balení jeho atomů může být kov měkký (jako alkalické kovy), tvrdý, lesklý nebo dobrý vodič elektřiny a horký.
Síla, která drží pohromadě atomy kovů, jako jsou ty, které tvoří malého muže v obraze a jeho notebooku, je větší než síla solí.
To lze experimentálně ověřit, protože krystaly solí lze před mechanickou silou rozdělit na několik polovin; zatímco kovová část (složená z velmi malých krystalů) je zdeformována.
Příklady odkazů
Následující čtyři sloučeniny zahrnují vysvětlené typy chemických vazeb:
-Fluorid sodný, NaF (Na+F-): iontový.
-Sodík, Na: kovový.
-Fluor, Fdva (F-F): nepolární kovalentní, vzhledem k tomu, že mezi oběma atomy je nulová ΔE, protože jsou identické.
-Fluorovodík, HF (H-F): polární kovalentní, protože v této sloučenině je fluor více elektronegativní než vodík.
Existují sloučeniny, jako je vitamin B.12, mající polární i iontové kovalentní vazby (v záporném náboji své fosfátové skupiny -PO4--). V některých složitých strukturách, jako jsou kovové shluky, mohou všechny tyto typy odkazů dokonce koexistovat.
Hmota nabízí ve všech svých projevech příklady chemických vazeb. Od kamene na dně rybníka a vody, která ho obklopuje, až po ropuchy, které na jeho okrajích skřečí.
I když vazby mohou být jednoduché, počet a prostorové uspořádání atomů v molekulární struktuře vytváří cestu pro bohatou rozmanitost sloučenin..
Důležitost chemické vazby
Jaká je důležitost chemické vazby? Nevyčíslitelný počet důsledků, které by rozpuštění bez chemické vazby uvolnilo, zdůrazňuje jeho enormní význam v přírodě:
-Bez něj by barvy neexistovaly, protože jeho elektrony by neabsorbovaly elektromagnetické záření. Částice prachu a ledu přítomné v atmosféře by zmizely, a proto by modrá barva oblohy ztmavla..
-Uhlík nemohl tvořit své nekonečné řetězce, ze kterých pocházejí biliony organických a biologických sloučenin.
-Proteiny nemohly být ani definovány v jejich základních aminokyselinách. Zmizely by cukry a tuky, stejně jako jakékoli sloučeniny uhlíku v živých organismech.
-Země by zůstala bez atmosféry, protože při absenci chemických vazeb ve svých plynech by neexistovala síla, která by je držela pohromadě. Nebyla by mezi nimi ani sebemenší mezimolekulární interakce.
-Hory by mohly zmizet, protože jejich horniny a minerály, i když byly těžké, nemohly obsahovat atomy zabalené uvnitř jejich krystalických nebo amorfních struktur..
-Svět by byl tvořen solitérními atomy neschopnými vytvářet pevné nebo kapalné látky. To by také mělo za následek zmizení veškeré transformace hmoty; to znamená, že by nedošlo k žádné chemické reakci. Prostě prchavé plyny všude.
Reference
- Harry B. Gray. (1965). Elektrony a chemické vazby. W.A. BENJAMIN, INC. P 36-39.
- Whitten, Davis, Peck a Stanley. Chemie. (8. vydání). CENGAGE Learning, s. 233, 251, 278, 279.
- Nave R. (2016). Chemické lepení. Obnoveno z: hyperphysics.phy-astr.gsu.edu
- Druhy chemických vazeb. (3. října 2006). Převzato z: dwb4.unl.edu
- Tvorba chemických vazeb: Role elektronů. [PDF]. Obnoveno z: cod.edu
- Nadace CK-12. (s.f.). Energie a tvorba kovalentních dluhopisů. Obnoveno z: chem.libretexts.org
- Quimitube. (2012). Souřadnicová nebo dativní kovalentní vazba. Obnoveno z: quimitube.com


Zatím žádné komentáře