
Atomové, viditelné a molekulární absorpční spektrum
A Absorpční spektrum Je produktem interakce světla s materiálem nebo látkou v kterémkoli z jejích fyzikálních stavů. Definice však jde nad rámec prostého viditelného světla, protože interakce zahrnuje široký segment rozsahu vlnových délek a energie elektromagnetického záření..
Některé pevné látky, kapaliny nebo plyny proto mohou absorbovat fotony různých energií nebo vlnových délek; od ultrafialového záření, po němž následuje viditelné světlo, k záření nebo infračervenému světlu, vstupující do mikrovlnných vlnových délek.

Lidské oko vnímá pouze interakce hmoty s viditelným světlem. Podobně je schopen uvažovat o difrakci bílého světla hranolem nebo médiem v jeho barevných složkách (horní obrázek).
Pokud by byl světelný paprsek „chycen“ poté, co prošel materiálem a analyzován, byla by nalezena absence určitých barevných pásů; to znamená, že černé pruhy by byly pozorovány v kontrastu s jeho pozadím. Toto je absorpční spektrum a jeho analýza je zásadní v instrumentální analytické chemii a astronomii..
Rejstřík článků
- 1 Atomová absorpce
- 1.1 Přechody a elektronické energie
- 2 Viditelné spektrum
- 3 Absorpční spektrum molekul
- 3.1 Methylenová modř
- 3.2 Chlorofyly a a b
- 4 Odkazy
Atomová absorpce
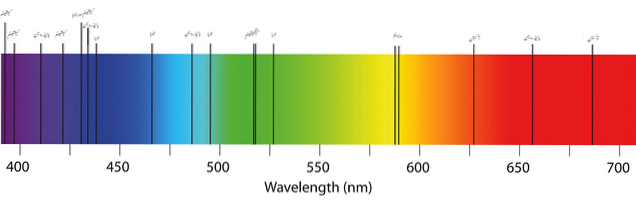
Horní obrázek ukazuje typické absorpční spektrum prvků nebo atomů. Všimněte si, že černé pruhy představují absorbované vlnové délky, zatímco ostatní jsou emitované. To znamená, že na rozdíl od toho by atomové emisní spektrum vypadalo jako černý pás s pruhy emitovaných barev..
Ale jaké jsou to pruhy? Jak stručně zjistit, zda atomy absorbují nebo emitují (bez zavedení fluorescence nebo fosforescence)? Odpovědi leží v povolených elektronických stavech atomů.
Elektronické přechody a energie
Elektrony jsou schopné se vzdálit od jádra a nechat jej pozitivně nabité, zatímco přecházejí z nižší energetické orbitální do vyšší energetické. Za tímto účelem, vysvětleným kvantovou fyzikou, absorbují fotony specifické energie k provedení uvedeného elektronového přechodu..
Energie je proto kvantována a nebudou absorbovat polovinu nebo tři čtvrtiny fotonu, ale specifické hodnoty frekvence (ν) nebo vlnové délky (λ).
Jakmile je elektron vzrušen, nezůstane po neomezenou dobu v elektronickém stavu vyšší energie; uvolní energii ve formě fotonu a atom se vrátí do svého bazálního nebo původního stavu.
V závislosti na tom, zda jsou zaznamenány absorbované fotony, bude získáno absorpční spektrum; a pokud jsou emitované fotony zaznamenány, výsledkem bude emisní spektrum.
Tento jev lze pozorovat experimentálně, pokud se zahřívají plynné nebo atomizované vzorky prvku. V astronomii lze porovnáním těchto spekter poznat složení hvězdy a dokonce i její polohu vzhledem k Zemi..
Viditelné spektrum
Jak je vidět na prvních dvou obrázcích, viditelné spektrum zahrnuje barvy od fialové po červenou a všechny jejich odstíny podle toho, kolik materiál absorbuje (tmavé nuance).
Vlnové délky červeného světla odpovídají hodnotám od 650 nm a dále (dokud nezmizí v infračerveném záření). A úplně vlevo, fialové a fialové tóny pokrývají hodnoty vlnové délky až 450 nm. Viditelné spektrum se pak pohybuje přibližně od 400 do 700 nm.
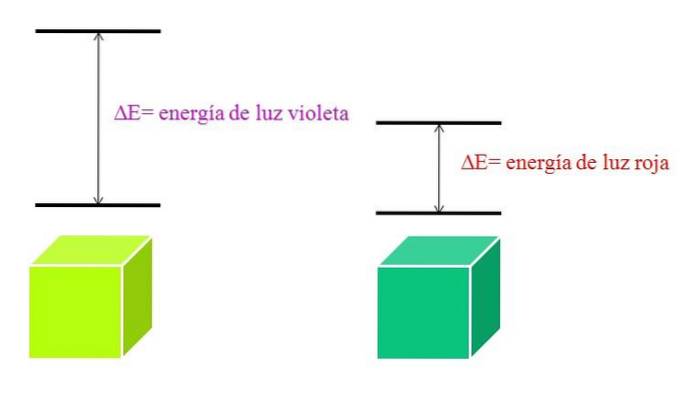
Jak λ roste, frekvence fotonu klesá, a proto i jeho energie. Fialové světlo má tedy vyšší energii (kratší vlnové délky) než červené světlo (delší vlnové délky). Materiál, který pohlcuje fialové světlo, proto zahrnuje elektronické přechody vyšších energií..
A pokud materiál absorbuje fialovou barvu, jakou barvu bude odrážet? Objeví se zelenožlutá barva, což znamená, že jeho elektrony dělají velmi energetické přechody; zatímco pokud materiál absorbuje červenou energii s nižší energií, bude odrážet modrozelenou barvu.
Když je atom velmi stabilní, obecně vykazuje velmi vzdálené elektronické stavy v energii; a proto budete muset absorbovat fotony vyšší energie, abyste umožnili elektronické přechody:
Absorpční spektrum molekul
Molekuly mají atomy a ty také absorbují elektromagnetické záření; jejich elektrony jsou však součástí chemické vazby, takže jejich přechody jsou odlišné. Jedním z velkých triumfů molekulární orbitální teorie je síla spojit absorpční spektra s chemickou strukturou.
Jednoduché, dvojné, trojné, konjugované vazby a aromatické struktury tedy mají své vlastní elektronické stavy; a proto absorbují velmi specifické fotony.
Tím, že má několik atomů, kromě mezimolekulárních interakcí a vibrací jejich vazeb (které také absorbují energii), mají absorpční spektra molekul podobu „hor“, které označují pásy, které tvoří vlnové délky, kde dochází k elektronovým přechodům.
Díky těmto spektrům lze sloučeninu charakterizovat, identifikovat a dokonce i pomocí vícerozměrné analýzy kvantifikovat.
Methylenová modř
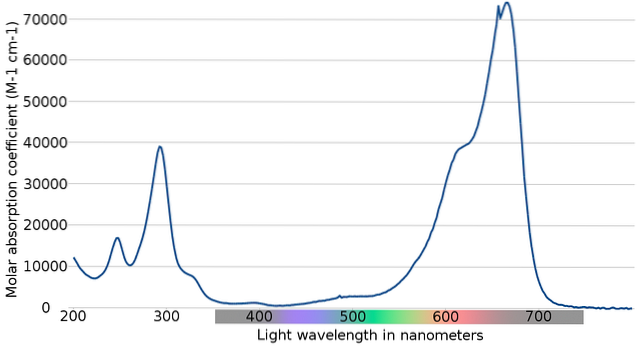
Horní obrázek ukazuje spektrum indikátoru methylenové modři. Jak jeho název evidentně naznačuje, má modrou barvu; ale lze to ověřit jeho absorpčním spektrem?
Všimněte si, že mezi vlnovými délkami 200 a 300 nm existují pásma. Mezi 400 a 500 nm nedochází téměř k žádné absorpci, to znamená, že neabsorbuje fialové, modré nebo zelené barvy.
Má však silné absorpční pásmo po 600 nm, a proto má nízkoenergetické elektronické přechody, které absorbují fotony červeného světla..
V důsledku toho a vzhledem k vysokým hodnotám molárních absorpcí vykazuje methylenová modř intenzivní modrou barvu..
Chlorofyly a a b
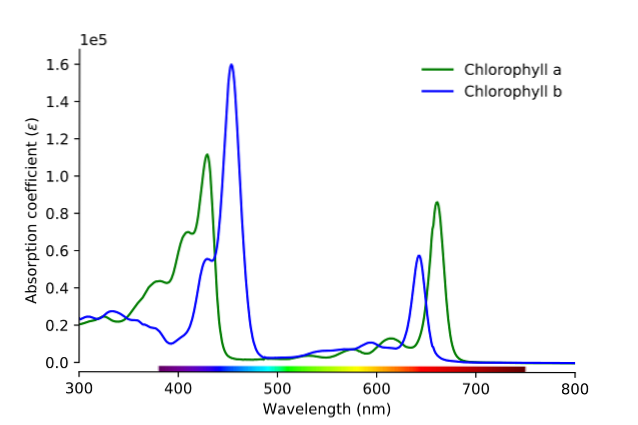
Jak je vidět na obrázku, zelená čára odpovídá absorpčnímu spektru chlorofylu a, zatímco modrá čára odpovídá spektru chlorofylu b.
Nejprve je třeba porovnat pásy, kde jsou molární absorpce největší; v tomto případě ty vlevo, mezi 400 a 500 nm. Chlorofyl a silně absorbuje fialové barvy, zatímco chlorofyl b (modrá čára) absorbuje modré barvy.
Absorpcí chlorofylu b kolem 460 nm se odráží modrá, žlutá barva. Na druhou stranu také silně absorbuje oranžové světlo v blízkosti 650 nm, což znamená, že vykazuje modrou barvu. Pokud se míchá žlutá a modrá, jaký je výsledek? Barva zelená.
A nakonec chlorofyl a absorbuje modrofialovou barvu a také červené světlo blízké 660 nm. Proto vykazuje zelenou barvu „změkčenou“ žlutou..
Reference
- Observatoire de Paris. (s.f.). Různé třídy spektra. Obnoveno z: media4.obspm.fr
- Rabanales University Campus. (s.f.). Spektrofotometrie: Absorpční spektra a kolorimetrická kvantifikace biomolekul. [PDF]. Obnoveno z: uco.es
- Day, R., & Underwood, A. (1986). Kvantitativní analytická chemie (páté vydání). PEARSON, Prentice Hall, s. 461-464.
- Reush W. (s.f.). Viditelná a ultrafialová spektroskopie. Obnoveno z: 2.chemistry.msu.edu
- David Darling. (2016). Absorpční spektrum. Obnoveno z: daviddarling.info
- Khan Academy. (2018). Absorpční / emisní potrubí. Obnoveno z: khanacademy.org



Zatím žádné komentáře