
Vlastnosti ethylenglykolu, chemická struktura, použití
The ethylenglykol je to nejjednodušší organická sloučenina z rodiny glykolů. Jeho chemický vzorec je C.dvaH6NEBOdva, zatímco jeho strukturní vzorec je HOCHdva-CHdvaACH. Glykol je alkohol charakterizovaný tím, že má dvě hydroxylové skupiny (OH) připojené ke dvěma sousedním atomům uhlíku v alifatickém řetězci.
Ethylenglykol je čirá, bezbarvá kapalina bez zápachu. Na obrázku níže máte jeho ukázku ve sklenici. Kromě toho má sladkou chuť a je velmi hygroskopický. Je to mírně těkavá kapalina, takže vyvíjí velmi malý tlak par, přičemž hustota páry je větší než hustota vzduchu..

Ethylenglykol je sloučenina s velkou rozpustností ve vodě, navíc je mísitelná s mnoha organickými sloučeninami; jako jsou alifatické alkoholy s krátkým řetězcem, aceton, glycerol atd. To je způsobeno jejich schopností darovat a přijímat vodíkové vazby z protických rozpouštědel (která mají H).
Ethylenglykol polymeruje na mnoho sloučenin, jejichž názvy jsou často zkráceny na PEG a číslo, které označuje jejich přibližnou molekulovou hmotnost. Například PEG 400 je relativně malý kapalný polymer. Zatímco velké PEG jsou bílé pevné látky mastného vzhledu.
Vlastnost ethylenglykolu snižovat teplotu tání a zvyšovat teplotu varu vody umožňuje jeho použití jako chladicí a antikoagulační látky ve vozidlech, letadlech a výpočetní technice.
Rejstřík článků
- 1 Vlastnosti
- 1.1 Jména
- 1,2 molární hmotnost
- 1.3 Fyzický vzhled
- 1.4 Zápach
- 1,5 příchuť
- 1.6 Hustota
- 1.7 Bod tání
- 1.8 Bod varu
- 1.9 Rozpustnost ve vodě
- 1.10 Rozpustnost v jiných rozpouštědlech
- 1.11 Bod vzplanutí
- 1.12 Hustota par
- 1.13 Tlak par
- 1.14 Rozklad
- 1.15 Skladovací teplota
- 1.16 Spalné teplo
- 1.17 Odpařovací teplo
- 1.18 Povrchové napětí
- 1,19 Index lomu
- 1.20 Disociační konstanta
- 1,21 pH
- 1,22 Rozdělovací koeficient oktanol / voda
- 2 Chemická struktura
- 3 Výroba
- 3.1 Oxidace ethylenu
- 3.2 Hydrolýza ethylenoxidu
- 3.3 Proces Omega
- 4 použití
- 4.1 Chladicí kapalina a nemrznoucí směs
- 4.2 Dehydratace
- 4.3 Výroba polymerů
- 4.4 Výbušniny
- 4.5 Ochrana dřeva
- 4.6 Jiné aplikace
- 5 Otrava a rizika
- 5.1 Příznaky expozice
- 5.2 Poškození při požití
- 5.3 Ekologické důsledky ethylenglykolu
- 6 Reference
Vlastnosti
Jména
Ethan-1,2-diol (IUPAC), ethylenglykol, monoethylenglykol (MEG), 1-2-dihydroxyethan.
Molární hmotnost
62,068 g / mol
Fyzický vzhled
Čirá, bezbarvá a viskózní kapalina.
Zápach
Toaleta
Chuť
Bonbón
Hustota
1,1132 g / cm3
Bod tání
-12,9 ° C
Bod varu
197,3 ° C
Rozpustnost ve vodě
Mísitelný s vodou, vysoce hygroskopická sloučenina.
Rozpustnost v jiných rozpouštědlech
Mísitelný s nižšími alifatickými alkoholy (methanol a ethanol), glycerolem, kyselinou octovou, acetonem a podobnými ketony, aldehydy, pyridiny, bázemi černouhelného dehtu a rozpustný v etheru. Prakticky nerozpustný v benzenu a jeho homologech, chlorovaných uhlovodících, petroletheru a olejích.
bod vznícení
111 ° C
Hustota par
2.14 ve vztahu ke vzduchu vzatému jako 1.
Tlak páry
0,092 mmHg při 25 ° C (extrapolací).
Rozklad
Při zahřátí na rozklad vydává štiplavý a dráždivý kouř.
Skladovací teplota
2-8 ° C
Spalné teplo
1 189,2 kJ / mol
Odpařovací teplo
50,5 kJ / mol
Povrchové napětí
47,99 mN / m při 25 ° C
Index lomu
1,4318 při 20 ° C
Disociační konstanta
pKa = 14,22 při 25 ° C
pH
6 až 7,5 (100 g / l vody) při 20 ° C
Rozdělovací koeficient oktanol / voda
Log P = - 1,69
Chemická struktura
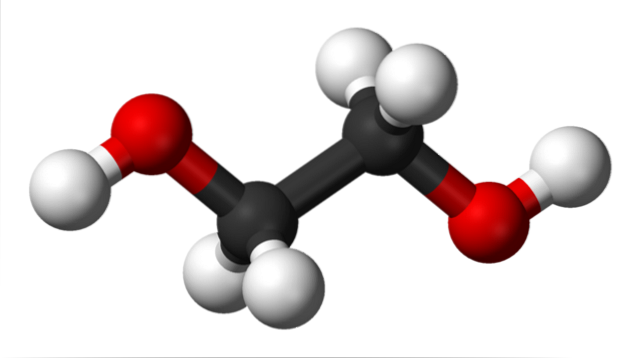
Na horním obrázku máme molekulu ethylenglykolu představovanou modelem koulí a pruhů. Černá koule odpovídá atomům uhlíku, které tvoří jejich C-C kostru, a na jejich koncích máme červenou a bílou kouli pro atomy kyslíku, respektive vodíku..
Je to symetrická molekula a na první pohled si můžeme myslet, že má permanentní dipólový moment; jejich vazby C-OH se však otáčejí, což zvýhodňuje dipól. Je to také dynamická molekula, která prochází neustálými rotacemi a vibracemi a je schopná tvořit nebo přijímat vodíkové vazby díky svým dvěma skupinám OH..
Ve skutečnosti jsou tyto interakce zodpovědné za to, že ethylenglykol má tak vysokou teplotu varu (197 ° C).
Když teplota klesne na -13 ° C, molekuly se spojí v ortorombickém krystalu, kde hrají důležitou roli rotamery; to znamená, že existují molekuly, které mají své O-H skupiny orientované v různých směrech.
Výroba
Oxidace ethylenu
Počáteční krok v syntéze ethylenglykolu je oxidace ethylenu na ethylenoxid. V minulosti reagoval ethylen s kyselinou chlornou za vzniku chlorohydrinu. Ten byl poté zpracován hydroxidem vápenatým za vzniku ethylenoxidu..
Metoda chlorohydrinu není příliš zisková a byla přepnuta na metodu přímé oxidace ethylenu v přítomnosti vzduchu nebo kyslíku za použití oxidu stříbrného jako katalyzátoru..
Hydrolýza ethylenoxidu
Hydrolýzou ethylenoxidu (EO) vodou pod tlakem se získá surová směs. Směs vody a glykolu se odpaří a recykluje, přičemž se frakční destilací oddělí monoethylenglykol od diethylenglykolu a triethylenglykolu..
Reakci hydrolýzy ethylenoxidu lze popsat následovně:
CdvaH4O + HdvaO => OH-CHdva-CHdva-OH (ethylenglykol nebo monoethylenglykol)
Společnost Mitsubishi Chemical vyvinula pomocí fosforu katalytický proces při přeměně ethylenoxidu na monoethylenglykol.
Omega proces
V procesu Omega se ethylenoxid nejprve přeměňuje na ethylenkarbonát reakcí s oxidem uhličitým (COdva). Poté se ethylenkarbonát podrobí katalytické hydrolýze, aby se získal monoethylenglykol s 98% selektivitou.
Existuje relativně nová metoda pro syntézu ethylenglykolu. Ta spočívá v oxidativní karbonylaci methanolu na dimethyloxalát (DMO) a jeho následné hydrogenaci na ethylenglykol..
Aplikace
Chladicí kapalina a nemrznoucí směs
Směs ethylenglykolu s vodou umožňuje snížení bodu tuhnutí a zvýšení bodu varu, což umožňuje motorům automobilů nezamrznout v zimě ani se v létě nepřehřívat.
Když procento ethylenglykolu ve směsi s vodou dosáhne 70%, bod tuhnutí je -55 ° C, takže směs ethylenglykol-voda může být použita jako chladicí kapalina a ochrana proti zamrznutí za podmínek, ve kterých může nastat.
Nízké teploty tuhnutí roztoků ethylenglykolu umožňují jeho použití jako nemrznoucí směsi v automobilových motorech; odmrazování křídel letadel; a při odmrazování čelních skel.
Používá se také k uchování biologických vzorků uchovávaných při nízkých teplotách, čímž se zabrání tvorbě krystalů, které mohou poškodit strukturu vzorků..
Vysoká teplota varu umožňuje použití roztoků ethylenglykolu k udržení nízkých teplot v zařízeních nebo zařízeních, která při provozu generují teplo, jako jsou: automobily, výpočetní technika, klimatizace atd..
Dehydratace
Ethylenglykol je velmi hygroskopická sloučenina, která umožnila jeho použití k úpravě plynů extrahovaných z podloží, které mají vysoký obsah vodních par. Odstranění vody z přírodních plynů zvýhodňuje jejich efektivní využití v příslušných průmyslových procesech..
Výroba polymerů
Ethylenglykol se používá k syntéze polymerů, jako je polyethylenglykol (PEG), polyethylentereftalát (PET) a polyurethan. PEG jsou rodina polymerů používaných v aplikacích, jako jsou: zahušťování potravin, léčba zácpy, kosmetika atd..
PET se používá při výrobě všech druhů jednorázových nádob, které se používají v různých druzích nápojů a potravin. Polyuretan se používá jako tepelný izolátor v chladničkách a jako výplň do různých typů nábytku.
Výbušniny
Používá se při výrobě dynamitu, což umožňuje, že snížením bodu tuhnutí nitroglycerinu jej lze skladovat s menším rizikem..
Ochrana dřeva
Ethylenglykol se používá k ošetření dřeva k ochraně proti jeho hnilobě, produkované působením hub. To je důležité pro uchování muzejních uměleckých děl.
Další aplikace
Ethylenglykol je přítomen v médiu pro suspendování vodivých solí v elektrolytických kondenzátorech a ve stabilizátorech sójové pěny. Používá se také při výrobě změkčovadel, elastomerů a syntetických vosků.
Ethylenglykol se používá k separaci aromatických a parafinických uhlovodíků. Kromě toho se používá při výrobě čisticích prostředků pro čisticí zařízení. Zvyšuje viskozitu a snižuje těkavost inkoustu, což usnadňuje jeho používání.
Ethylenglykol lze také použít ve slévárně formovacího písku a jako mazivo při mletí skla a cementu. Používá se také jako přísada do hydraulických brzdových kapalin a jako meziprodukt při syntéze esterů, etherů, polyesterových vláken a pryskyřic..
Mezi pryskyřice, ve kterých se jako surovina používá ethylenglykol, patří alkyd, používaný jako základ alkydových barev, používaný v automobilových a architektonických barvách..
Otrava a rizika
Příznaky expozice
Ethylenglykol má nízkou akutní toxicitu při kontaktu s pokožkou nebo při vdechování. Jeho toxicita se však plně projeví při požití, což je indikováno jako smrtelná dávka ethylenglykolu 1,5 g / kg tělesné hmotnosti nebo 100 ml pro 70 kg dospělého..
Akutní expozice ethylenglykolu vyvolává následující příznaky: vdechování způsobuje kašel, závratě a bolesti hlavy. Na pokožce při kontaktu s ethylenglykolem dochází k suchu. Mezitím v očích vyvolává zarudnutí a bolest.
Poškození požití
Požití ethylenglykolu se projevuje bolestmi břicha, nevolností, bezvědomím a zvracením. Nadměrný příjem ethylenglykolu má škodlivý účinek na centrální nervový systém (CNS), kardiovaskulární funkce a morfologii a fyziologii ledvin..
V důsledku selhání fungování CNS dochází k paralýze nebo nepravidelnému pohybu očí (nystagmus). V kardiopulmonálním systému je vysoký krevní tlak, tachykardie a možné srdeční selhání. Existují vážné změny v ledvinách, které jsou produktem otravy ethylenglykolem.
V renálních tubulech dochází k dilataci, degeneraci a depozici oxalátu vápenatého. To je vysvětleno následujícím mechanismem: ethylenglykol je metabolizován enzymem mléčná dehydrogenáza za vzniku glykoaldehydu.
Glykoaldehyd vede ke kyselině glykolové, glyoxylové a šťavelové. Kyselina šťavelová se rychle sráží s vápníkem za vzniku oxalátu vápenatého, jehož nerozpustné krystaly se ukládají v renálních tubulech, což v nich vyvolává morfologické změny a dysfunkci, což může vést k selhání ledvin..
Kvůli toxicitě ethylenglykolu byl v některých aplikacích postupně nahrazován propylenglykolem.
Ekologické důsledky ethylenglykolu
Během odmrazování vypouštějí letouny značné množství ethylenglykolu, který se nakonec hromadí na přistávacích pásech, což při promytí způsobí, že voda přenese ethylenglykol přes drenážní systém do řek, kde jeho toxicita ovlivňuje život letadlo. ryby.
Toxicita ethylenglykolu však sama o sobě není hlavní příčinou ekologických škod. Během jeho aerobní biodegradace se spotřebovává značné množství kyslíku, což způsobuje jeho pokles v povrchových vodách.
Na druhé straně může jeho anaerobní biodegradace uvolňovat toxické látky pro ryby, jako je acetaldehyd, ethanol, acetát a methan..
Reference
- Wikipedia. (2019). Ethylenglykol. Obnoveno z: en.wikipedia.org
- Národní centrum pro biotechnologické informace. Databáze PubChem. (2019). 1,2-ethandiol. CID = 174. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Artem Cheprasov. (2019). Ethylenglykol: struktura, vzorec a použití. Studie. Obnoveno z: study.com
- Leroy G. Wade. (27. listopadu 2018). Ethylenglykol. Encyklopedie Britannica. Obnoveno z: britannica.com
- A. Dominic Fortes & Emmanuelle Suard. (2011). Krystalové struktury ethylenglykolu a monohydrátu ethylenglykolu. J. Chem. Phys. 135, 234501. doi.org/10.1063/1.3668311
- Icis. (24. prosince 2010). Proces výroby a výroby ethylenglykolu (EG). Obnoveno z: icis.com
- Lucy Bell Young. (2019). Jaká jsou použití ethylenglykolu? Činidlo. Obnoveno z: chemikálie.co.uk
- QuimiNet. (2019). Původ, typy a aplikace ethylenglykolů. Obnoveno z: quiminet.com
- R. Gomes, R. Liteplo a M.E. Pokorný. (2002). Ethylenglykol: Aspekty lidského zdraví. Světová zdravotnická organizace v Ženevě. [PDF]. Obnoveno z: who.int



Zatím žádné komentáře