
Faktor stlačitelnosti, jak počítat, příklady a cvičení
The faktor stlačitelnosti Z, nebo kompresní faktor pro plyny, je bezrozměrná hodnota (bez jednotek), která je zavedena jako korekce ve stavové rovnici ideálních plynů. Tímto způsobem se matematický model více podobá pozorovanému chování plynu..
V ideálním plynu je stavová rovnice vztahující se k proměnným P (tlak), V (objem) a T (teplota): P.V. ideál = n.R.T. s n = počet molů a R = konstanta ideálního plynu. Přidáním opravy pro faktor stlačitelnosti Z se tato rovnice stává:
P.V = Z.n.R.T.
Rejstřík článků
- 1 Jak vypočítat faktor stlačitelnosti?
- 2 Příklady
- 2.1 Faktor stlačitelnosti v ideálních plynech, vzduchu, vodíku a vodě
- 3 Vyřešená cvičení
- 3.1 Cvičení 1
- 3.2 Cvičení 2
- 4 Odkazy
Jak vypočítat faktor stlačitelnosti?
Vezmeme-li v úvahu, že molární objem je PROTIchladný = V / n, máme skutečný molární objem:
P . PROTInemovitý = Z. R. T → Z = PV nemovitý/ RT
Protože faktor stlačitelnosti Z závisí na podmínkách plynu, vyjadřuje se jako funkce tlaku a teploty:
Z = Z (P, T)
Při srovnání prvních dvou rovnic lze vidět, že pokud je počet molů n roven 1, molární objem skutečného plynu souvisí s objemem ideálního plynu pomocí:
PROTInemovitý / Videál = Z → V nemovitý = Z Videál
Když tlak překročí 3 atmosféry, většina plynů se přestane chovat jako ideální plyny a skutečný objem se od ideálního výrazně liší.
Toto uskutečnil ve svých experimentech nizozemský fyzik Johannes Van der Waals (1837-1923), který ho vedl k vytvoření modelu, který lépe vyhovoval praktickým výsledkům než rovnice ideálního plynu: Vanova rovnice stavu. Der Waals.
Příklady
Podle rovnice P.V.nemovitý= Z.n.RT, Pro ideální plyn Z = 1. Avšak ve skutečných plynech, jak se zvyšuje tlak, roste i hodnota Z. To dává smysl, protože čím vyšší je tlak, tím více mají molekuly plynu srážky, a proto se odpudivé síly zvyšují a s tím objem.
Na druhou stranu, při nižších tlacích se molekuly pohybují volněji a odpudivé síly se snižují. Proto se očekává nižší objem. Pokud jde o teplotu, když se zvyšuje, Z klesá.
Jak poznamenal Van der Waals, v blízkosti takzvaného kritického bodu se chování plynu značně liší od chování ideálního plynu..
Kritický bod (TC, PC) jakékoli látky jsou hodnoty tlaku a teploty, které určují její chování před fázovou změnou:
-TC je teplota, nad kterou dotyčný plyn nezkapalňuje.
-PC je minimální tlak potřebný ke zkapalnění plynu při teplotě TC
Každý plyn má svůj vlastní kritický bod, který však definuje teplotu a snížený tlak Tr A strr jak následuje:
Pr = P / PC
PROTIr = V / VC
Tr = T / TC
Je pozorováno, že uzavřený plyn je identický PROTIr Y Tr vyvíjí stejný tlak Pr. Z tohoto důvodu, pokud je Z vykresleno jako funkce Pr pro sebe Tr, každý bod na této křivce je stejný pro jakýkoli plyn. Tomu se říká princip odpovídajících stavů.
Faktor stlačitelnosti v ideálních plynech, vzduchu, vodíku a vodě
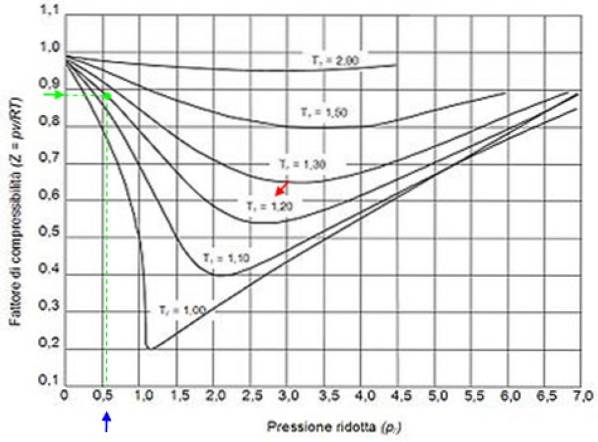
Níže je křivka stlačitelnosti pro různé plyny při různých snížených teplotách. Zde je několik příkladů Z pro některé plyny a postup pro nalezení Z pomocí křivky.
Ideální plyny
Ideální plyny mají Z = 1, jak je vysvětleno na začátku.
Vzduch
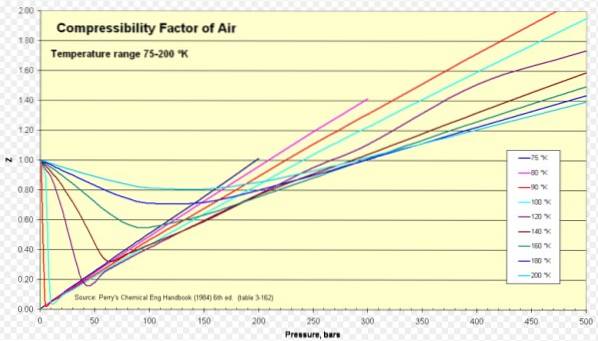
Pro vzduch je Z přibližně 1 v širokém rozsahu teplot a tlaků (viz obrázek 1), kde model ideálního plynu poskytuje velmi dobré výsledky.
Vodík
Z> 1 pro všechny tlaky.
Voda
Chcete-li najít Z pro vodu, potřebujete hodnoty kritických bodů. Kritickým bodem vody je: PC = 22,09 MPa a TC= 374,14 ° C (647,3 K). Opět je třeba vzít v úvahu, že faktor stlačitelnosti Z závisí na teplotě a tlaku..
Předpokládejme například, že chcete najít Z vody při 500 ° C a 12 MPa. První věcí, kterou musíte udělat, je vypočítat sníženou teplotu, pro kterou musí být stupně Celsia převedeny na Kelvin: 50 ° C = 773 K:
Tr = 773 / 647,3 = 1,2
Pr = 12 / 22,09 = 0,54
S těmito hodnotami umístíme do grafu obrázku křivku odpovídající Tr = 1,2, označeno červenou šipkou. Dále hledáme hodnotu P na vodorovné oser blíže k 0,54, označeno modře. Nyní nakreslíme svislici, dokud neprovedeme křivku Tr = 1,2 a nakonec se promítne z tohoto bodu na svislou osu, kde odečteme přibližnou hodnotu Z = 0,89.
Vyřešená cvičení
Cvičení 1
K dispozici je vzorek plynu o teplotě 350 K a tlaku 12 atmosfér, s molárním objemem o 12% větším, než předpovídá zákon o ideálním plynu. Vypočítat:
a) Kompresní faktor Z.
b) Molární objem plynu.
c) Podle předchozích výsledků uveďte, které jsou dominantní síly v tomto vzorku plynu.
Data: R = 0,082 L.atm / mol.K
Řešení
S vědomím, že V nemovitý je o 12% větší než PROTIideál :
PROTInemovitý = 1,12Videál
Z = V nemovitý / Videál = 1,12
Řešení b
P. PROTInemovitý = Z. R. T → Vnemovitý = (1,12 x 0,082 x 350/12) L / mol = 2,14 L / mol.
Řešení c
Odpudivé síly jsou ty, které převládají, protože se zvýšil objem vzorku.
Cvičení 2
Existuje 10 molů etanu uzavřených v objemu 4,86 l při 27 ° C. Tlak vyvíjený ethanem zjistíte z:
a) Ideální model plynu
b) Van der Waalsova rovnice
c) Najděte faktor komprese z předchozích výsledků.
Údaje pro ethan
Van der Waalsovy koeficienty:
a = 5 489 dm6. bankomat. krtek-dva a b = 0,06380 dm3. krtek-1.
Kritický tlak: 49 atm. Kritická teplota: 305 K.
Řešení
Teplota přechází na kelvin: 27 ° C = 27 +273 K = 300 K, pamatujte také na to, že 1 litr = 1 L = 1 dm3.
Poté se dodaná data nahradí rovnicí ideálního plynu:
P.V = n.R.T → P = (10 x 0,082 x 300 / 4,86 l) atm = 50,6 atm
Řešení b
Van der Waalsova stavová rovnice je:
Kde a a b jsou koeficienty dané výpisem. Při mazání P:
Řešení c
Vypočítáme snížený tlak a teplotu:
Pr = 35,2 / 49 = 0,72
Tr = 300/305 = 0,98 ≈ 1
S těmito hodnotami hledáme hodnotu Z v grafu na obrázku 2 a zjistíme, že Z je přibližně 0,7.
Reference
- Atkins, P. 1999. Fyzikální chemie. Edice Omega.
- Cengel, Y. 2012. Termodynamika. 7ma Edice. Mcgraw kopec.
- Engel, T. 2007. Úvod do fyzikochemie: termodynamika. Pearson.
- Levine, I. 2014. Principles of Physico-chemistry. 6.. Edice. Mcgraw kopec.
- Wikipedia. Faktor stlačitelnosti. Obnoveno z: en.wikipedia.org.



Zatím žádné komentáře