
Struktura, vlastnosti, rizika a použití hydrogenuhličitanu vápenatého
The hydrogenuhličitan vápenatý je anorganická sůl s chemickým vzorcem Ca (HCO3)dva. V přírodě pochází z uhličitanu vápenatého přítomného ve vápencových kamenech a minerálů, jako je kalcit.
Hydrogenuhličitan vápenatý je ve vodě rozpustnější než uhličitan vápenatý. Tato vlastnost umožnila vznik krasových systémů ve vápencových skalách a strukturování jeskyní..

Podzemní voda, která prochází trhlinami, se nasycuje přemísťováním oxidu uhličitého (COdva). Tyto vody erodují vápencové kameny uvolňující uhličitan vápenatý (CaCO3), který vytvoří hydrogenuhličitan vápenatý podle následující reakce:
Zloděj3s) + COdva(g) + HdvaO (l) => Ca (HCO3)dva(aq)
K této reakci dochází v jeskyních, kde vznikají velmi tvrdé vody. Hydrogenuhličitan vápenatý není společně s Ca v pevném stavu, ale ve vodném roztokudva+, hydrogenuhličitan (HCO3-) a uhličitanový ion (CO3dva-).
Následně snížením nasycení oxidem uhličitým ve vodě dochází k reverzní reakci, tj. Transformaci hydrogenuhličitanu vápenatého na uhličitan vápenatý:
Ca (HCO3)dva(aq) => COdva (g) + HdvaO (l) + CaCO3 (s)
Uhličitan vápenatý je špatně rozpustný ve vodě, což způsobuje, že se srážení vyskytuje ve formě pevné látky. Výše uvedená reakce je velmi důležitá při tvorbě stalaktitů, stalagmitů a dalších speleotémů v jeskyních..
Tyto skalní struktury jsou tvořeny kapkami vody, které padají ze stropu jeskyní (horní obrázek). CaCO3 přítomný ve vodních kapičkách, krystalizuje a vytvoří výše uvedené struktury.
Skutečnost, že se hydrogenuhličitan vápenatý nenachází v pevném stavu, znesnadnila jeho použití a bylo nalezeno několik příkladů. Stejně tak je těžké najít informace o jeho toxických účincích. Existuje zpráva o souboru vedlejších účinků při jeho použití jako léčby k prevenci osteoporózy.
Struktura
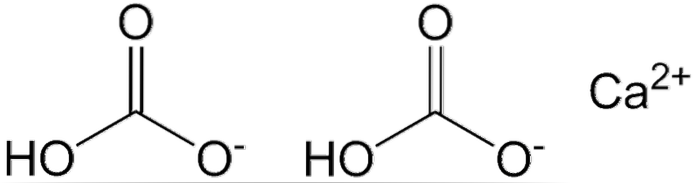
Na obrázku výše jsou zobrazeny dva HCO anionty3- a kation Cadva+ elektrostaticky interagující. Ca.dva+ podle obrázku by měl být umístěn uprostřed, protože tímto způsobem HCO3- neodrazili by se navzájem kvůli svým záporným nábojům.
Záporný náboj u HCO3- delokalizuje mezi dvěma atomy kyslíku rezonancí mezi karbonylovou skupinou C = O a vazbou C-O-; zatímco v CO3dva-, je delokalizován mezi třemi atomy kyslíku, protože vazba C-OH je deprotonována a může proto přijímat záporný náboj rezonancí.
Geometrie těchto iontů může být považována za sféry vápníku obklopené plochými trojúhelníky uhličitanů s hydrogenovaným koncem. Pokud jde o poměr velikosti, je vápník znatelně menší než ionty HCO.3-.
Vodní roztoky
Ca (HCO3)dva Nemůže tvořit krystalické pevné látky a ve skutečnosti se skládá z vodných roztoků této soli. V nich nejsou ionty samy, jako na obrázku, ale jsou obklopeny molekulami H.dvaNEBO.
Jak interagují? Každý iont je obklopen hydratační koulí, která bude záviset na kovu, polaritě a struktuře rozpuštěných druhů..
Ca.dva+ koordinuje s atomy kyslíku ve vodě za vzniku vodného komplexu Ca (OHdva)ndva+, kde n je obecně považováno za šest; tj. „vodný osmistěn“ kolem vápníku.
Zatímco HCO anionty3- interagují buď s vodíkovými vazbami (OdvaCO-H-OHdva) nebo s atomy vodíku ve vodě ve směru delokalizovaného záporného náboje (HOCOdva- H-OH, interakce dipól-ion).
Tyto interakce mezi Cadva+, HCO3- a voda jsou tak účinné, že díky nim je hydrogenuhličitan vápenatý v tomto rozpouštědle velmi dobře rozpustný; na rozdíl od CaCO3, ve kterém jsou elektrostatické přitažlivosti mezi Cadva+ a CO3dva- jsou velmi silné a sráží se z vodného roztoku.
Kromě vody existují molekuly COdva kolem, které reagují pomalu a poskytují více HCO3- (v závislosti na hodnotách pH).
Hypotetická pevná látka
Zatím velikosti a náboje iontů v Ca (HCO3)dva, ani přítomnost vody, vysvětlete, proč tuhá sloučenina neexistuje; tj. čisté krystaly, které lze charakterizovat rentgenovou krystalografií Ca (HCO3)dva není to nic jiného než ionty přítomné ve vodě, ze které kavernózní útvary nadále rostou.
Ano, Ca.dva+ a HCO3- lze izolovat z vody a vyhnout se následující chemické reakci:
Ca (HCO3)dva(aq) → CaCO3s) + COdva(g) + HdvaO (l)
Ty by pak mohly být seskupeny do bílé krystalické pevné látky se stechiometrickými poměry 2: 1 (2HCO3/ 1Ca). Neexistují žádné studie o jeho struktuře, ale dalo by se to srovnat se strukturou NaHCO3 (od hydrogenuhličitanu hořečnatého, Mg (HCO3)dva, neexistuje jako pevná látka) nebo s obsahem CaCO3.
Stabilita: NaHCO3 vs Ca (HCO3)dva
NaHCO3 krystalizuje v monoklinickém systému a CaCO3 v trigonálních (kalcitových) a ortorombických (aragonitových) systémech. Pokud byl nahrazen Na+ od Cadva+, krystalická mřížka by byla destabilizována větším rozdílem ve velikostech; tj. Na+ protože je menší, vytváří stabilnější krystal s HCO3- ve srovnání s Cadva+.
Ve skutečnosti Ca (HCO3)dva(aq) potřebuje odpařit vodu, aby se její ionty mohly seskupit v krystalu; ale jeho krystalická mřížka není dostatečně silná, aby to dokázala při pokojové teplotě. Při ohřevu vody dochází k rozkladné reakci (výše uvedená rovnice).
Být iontem Na+ v roztoku by vytvořil krystal s HCO3- před jeho tepelným rozkladem.
Důvod, proč Ca (HCO3)dva nekrystaluje (teoreticky), je to způsobeno rozdílem v iontových poloměrech nebo velikostech jeho iontů, které před rozkladem nemohou vytvořit stabilní krystal.
Ca (HCO3)dva vs CaCO3
Pokud naopak H+ do krystalových struktur CaCO3, jejich fyzikální vlastnosti by se drasticky změnily. Možná, že jejich body tání významně klesají, a dokonce i morfologie krystalů se nakonec upraví..
Stálo by za to vyzkoušet syntézu Ca (HCO3)dva pevný? Potíže by mohly překonat očekávání a sůl s nízkou strukturní stabilitou nemusí poskytovat další významné výhody v jakékoli aplikaci, kde se již používají jiné soli..
Fyzikální a chemické vlastnosti
Chemický vzorec
Ca (HCO3)dva
Molekulární váha
162,11 g / mol
Fyzický stav
Nepřichází v pevném stavu. Nachází se ve vodném roztoku a pokusy přeměnit ji na pevnou látku odpařením vody nebyly úspěšné, protože se z ní stává uhličitan vápenatý..
Rozpustnost ve vodě
16,1 g / 100 ml při 0 ° C; 16,6 g / 100 ml při 20 ° C a 18,4 g / 100 ml při 100 ° C. Tyto hodnoty svědčí o vysoké afinitě molekul vody k iontům Ca (HCO3)dva, jak je vysvětleno v předchozí části. Mezitím pouze 15 mg CaCO3 rozpustí se v jednom litru vody, což odráží jejich silné elektrostatické interakce.
Protože Ca (HCO3)dva nemůže tvořit pevnou látku, její rozpustnost nelze určit experimentálně. Vzhledem k podmínkám vytvořeným COdva rozpuštěný ve vodě obklopující vápenec, lze vypočítat hmotnost vápníku rozpuštěného při teplotě T; hmotnost, která by se rovnala koncentraci Ca (HCO3)dva.
Při různých teplotách se rozpuštěná hmota zvyšuje, jak ukazují hodnoty při 0, 20 a 100 ° C. Poté se podle těchto experimentů stanoví, kolik Ca (HCO3)dva rozpouští se v blízkosti CaCO3 ve vodném médiu provzdušňovaném COdva. Jakmile unikne COdva plynný, CaCO3 se vysráží, ale ne Ca (HCO3)dva.
Bod tání a bod varu
Krystalová mřížka Ca (HCO3)dva je mnohem slabší než CaCO3. Pokud jej lze získat v pevném stavu a teplota, při které se taví, se měří pomocí fusiometru, byla by jistě získána hodnota hluboko pod 899 ° C. Obdobně by se to dalo očekávat při stanovení bodu varu..
Bod hoření
Není palivo.
Rizika
Protože tato sloučenina neexistuje v pevné formě, je nepravděpodobné, že by manipulace s jejími vodnými roztoky představovala riziko, protože oba ionty Cadva+ jako HCO3- nejsou škodlivé při nízkých koncentracích; a proto větší riziko, které by bylo požitím těchto řešení, by mohlo být způsobeno pouze nebezpečnou dávkou požitého vápníku.
Pokud by sloučenina měla tvořit pevnou látku, i když možná fyzicky odlišnou od CaCO3, jeho toxické účinky nesmí po fyzickém kontaktu nebo vdechování přesahovat pouhé nepohodlí a sucho.
Aplikace
-Roztoky hydrogenuhličitanu vápenatého se již dlouho používají k praní starých papírů, zejména uměleckých děl nebo historicky důležitých dokumentů..
-Použití roztoků hydrogenuhličitanu je užitečné nejen proto, že neutralizují kyseliny v papíru, ale také poskytují alkalickou rezervu uhličitanu vápenatého. Druhá sloučenina poskytuje ochranu pro budoucí poškození papíru..
-Stejně jako ostatní hydrogenuhličitany se používá v chemických kvasnicích a v šumivých tabletách nebo práškových formulacích. Kromě toho se hydrogenuhličitan vápenatý používá jako přísada do potravin (vodné roztoky této soli).
-V prevenci osteoporózy se používají roztoky hydrogenuhličitanu. V jednom případě však byly pozorovány vedlejší účinky, jako je hyperkalcémie, metabolická alkalóza a selhání ledvin..
-Hydrogenuhličitan vápenatý se občas podává intravenózně, aby se upravil depresivní účinek hypokalémie na srdeční funkce.
-A nakonec poskytuje tělu vápník, který je mediátorem svalové kontrakce, a současně upravuje acidózu, která může nastat při hypokalemickém stavu..
Reference
- Wikipedia. (2018). Hydrogenuhličitan vápenatý. Převzato z: en.wikipedia.org
- Sirah Dubois. (3. října 2017). Co je hydrogenuhličitan vápenatý? Obnoveno z: livestrong.com
- Science Learning Hub. (2018). Uhličitanová chemie. Obnoveno z: sciencelearn.org.nz
- PubChem. (2018). Hydrogenuhličitan vápenatý. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Amy E. Gerbracht a Irene Brückle. (1997). Využití roztoků hydrogenuhličitanu vápenatého a hydrogenuhličitanu hořečnatého v malých konzervačních dílnách: Výsledky průzkumu. Obnoveno z: cool.conservation-us.org

Zatím žádné komentáře