
Charakteristické chemické jevy a příklady
The chemické jevy Jsou to všechny ty, které zahrnují řadu chemických reakcí a které se vyskytují v každodenním životě. I když je pravda, že chemické reakce lze studovat nebo provádět v laboratoři, chemické jevy lze pozorovat kdekoli; venku, v oblacích, v našich tělech nebo v samotné kuchyni.
Mezi příklady chemických změn patří spalování dřeva, trávení jídla, vaření vajec, rezavé železo, pečení dortu, hnijící ovoce, pečení masa, exploze ohňostrojů a další..

Je snadné rozpoznat chemické jevy, i když nejsou izolované, ale ve spojení s fyzickými (nebo biologickými) změnami. O chemickém jevu se říká, že nastal, když bylo pozorováno zvýšení teploty, uvolňování plynů, náhlé osvětlení, tvorba sraženin; nebo změny vůně, barvy nebo textury.
Všechny chemické jevy však sdílejí společnou transformaci identity hmoty; rozbití vazeb za účelem navázání nových, zmizení reaktantů pro generování produktů.
„Jednoduchý“ chemický jev může zahrnovat nebo zastrčit obrovské množství chemických reakcí, které podléhají jednomu nebo více mechanismům. K tomu dochází zejména při vaření, pečení (cookies na obrázku výše) nebo jídle, stejně jako u zajímavých biochemických procesů, jako je bioluminiscence..
Rejstřík článků
- 1 Funkce
- 2 Příklady
- 2.1 Krystalizace minerálů
- 2.2 Spalování
- 2.3 Kyselý déšť
- 2.4 Produkce a poškození ozónu
- 2.5 Fermentace
- 2.6 Vaření
- 2.7 Karamelizace a Maillardova reakce
- 2.8 Bioluminiscence
- 3 Odkazy
Vlastnosti
Každá samostatná chemická reakce má sadu charakteristik, které jim umožňují rozpoznat nebo klasifikovat je od ostatních; ať už jde o dvojité vytěsnění (metatéza), srážení, neutralizace, adice, izomerizace, oxidační redukce, hydrogenace, spalování, pyrolýza, zmýdelnění, polymerace a mnoho dalších..
Některé z nich mohou být reverzibilní (produkty znovu vytvářejí reaktanty) nebo nevratné (dochází pouze k tvorbě produktu). Některé jsou také exotermické, endotermické, pomalé nebo rychlé (s katalyzátorem nebo bez něj).
Všichni se však shodují na změně identity hmoty (atom, funkční skupina, molekula atd.). To způsobí změnu jedné z vlastností systému, kterými jsou mimo jiné barva, vůně, pH, teplota, tlak, viskozita, hmotnost, objem, hustota, index lomu..
Je také běžné pozorovat bublání, výskyt sraženiny nebo dvojitých fází, záblesky nebo výbuchy. Chemický jev je pak charakterizován kombinací takových změn a může také sestávat z řady reakcí nebo transformací, které spolu úzce souvisejí..
To je důvod, proč se v závislosti na hranolu, se kterým se dívá, chemické jevy odkazují hlavně na všechny přírodní nebo denní procesy, u nichž je vnímáno, že došlo k jedné nebo více současných chemických reakcích.
Příklady
Minerální krystalizace

Ačkoli ne všechny mechanismy krystalizace minerálů jsou přísně chemickými jevy, je to tak, že vycházejí z vodného roztoku, který se pomalu odpařuje, zatímco se ionty seskupují a tvoří krystaly soli..
Vodní proudy mohou přenášet ionty ze skal do jiných oblastí, kde se nakonec odpaří a zanechají stopu krystalů; jak se to děje například ve slaných jezerech.
Spalování
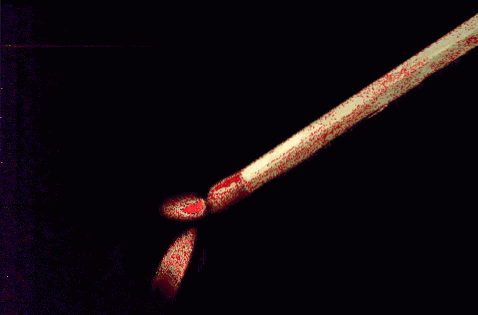
Tam, kde je oheň, dochází k intenzivní a vysoce exotermické oxidaci. Když zapálíte hlavu zápalky, spaluje se s kyslíkem ve vzduchu za vzniku oxidů, o čemž svědčí nejen teplo, ale také změna barvy v zápalce z červené na černou..
Oheň je proto chemický jev, který zahrnuje tvorbu mnoha oxidů; i když se vyskytne v lese, džungli nebo na horách, bude se skládat téměř výhradně z oxidu uhelnatého a oxidů dusíku a síry.
Kyselý déšť

Kyselý déšť je chemický jev, který zahrnuje hydrataci různých oxidů plynných kyselin (NOX, SW3, ClOdva, COdva). Tyto plynné oxidy se při interakci s kapičkami vody v oblacích transformují na příslušné oxokyseliny (HNO3, HdvaSW4, HClO3, HdvaCO3), které jsou nakonec vyhozeny do deště.
Kyselé deště se vyznačují vysokým obsahem HNO3 a HdvaSW4, ovlivňující vodní ekosystémy, plodiny, okyselující říční vodu a zhoršující se mramorové sochy.
Produkce a poškození ozónu

Ozon ve stratosféře vzniká, když kyslík reaguje s ultrafialovým zářením ze slunce; a jeho přirozená destrukce, i když jiným mechanismem, regeneruje kyslík znovu.
Existují však chemické druhy, které se v důsledku ultrafialového záření rozkládají na volné radikály, které ničí ozon a inhibují jeho ochranný účinek..
Kvašení
Fermentace je příkladem chemického jevu, protože mikroorganismy katalyzují reakce na organickém substrátu, kterým je obvykle jídlo, džus nebo nápoj, za účelem drastické změny jeho organoleptických vlastností; zvláště pokud jde o chuť, jako u piva a vína.
Vařit

Mohla by být napsána kniha o všech chemických jevech, ke kterým dochází při vaření. Za prvé, použití ohně již znamená denaturaci bílkovin, z nichž se skládá jídlo, jejich dehydrataci a narušení určitých vazeb za vzniku produktů, které zesilují jejich chutě a barvy..
Vaření vejce, pečení chleba nebo sušenky, smažení kuřete nebo steaků, vaření kávy, ohřívání těstovin, oblékání salátu octem, kvašení ananasu, přidání citronu k rybám k neutralizaci těkavých aminů atd., Jsou v zásadě příklady chemických jevů.
Karamelizace a Maillardova reakce

Dalším zvláštním chemickým jevem, který se v kuchyni často vyskytuje, je karamelizace. To spočívá v částečném spalování cukrového roztoku, dokud nezezlatne nebo nezhnědne; to znamená, že se zastaví, jakmile je karamel připraven.
Cukry se začínají dehydratovat působením tepla a vytvářejí souhrn molekul; některé malé (furanon a maltol), díky nimž má karamel charakteristickou vůni; ostatní polymerní (karamelina a karamelano), odpovědné za karamelové barvy.
Když jsou kromě bílkovin doprovázeny cukry, dochází k Maillardově reakci, kde nyní cukry reagují s aminoskupinami těchto látek.
Opět je typické pozorovat chemický jev, který je součástí takové reakce při pečení sušenek nebo koláčů, při přípravě piva, při smažení slaniny, při hnědnutí masa, při pečení kuřete, v opékání obilovin atd.
Bioluminiscence

A konečně, a neméně důležité nebo zvědavé, máme bioluminiscenci, kde jsou organismy nebo tvorové schopni generovat prostřednictvím světla enzymu luciferázy na protein luciferinu jejich vlastní světlo. Jasný příklad je vidět u světlušek a jejich žluté blikání po celou noc..
Reference
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Elsevier. (2019). Chemické jevy. Obnoveno z: sciencedirect.com
- Helmenstine, Anne Marie, Ph.D. (16. října 2019). Příklady chemických reakcí v každodenním životě. Obnoveno z: thoughtco.com
- Wikipedia. (2019). Chemická reakce. Obnoveno z: en.wikipedia.org
- Rice University. (2019). Klasifikace chemických reakcí. Obnoveno z: openstax.org
- Biomimikrický institut. (27. ledna 2017). Chemistry of Nature. Obnoveno z: asknature.org
- Ashley Hamer. (14. května 2018). 10 způsobů, jak hacknout vaše vaření chemií. Obnoveno z: curiosity.com
- Složený úrok. (2018). Chemie potravin - Maillardova reakce. Obnoveno z: compoundchem.com
- Ashish. (25. března 2018). Proč cukr při tavení zhnědne? Obnoveno z: scienceabc.com


Zatím žádné komentáře