
Struktura fluoridu vápenatého (CaF2), vlastnosti, použití
The fluorid vápenatý Je to anorganická pevná látka tvořená jedním atomem vápníku (Ca) a dvěma atomy fluoru (F). Jeho chemický vzorec je CaFdva a je to krystalická šedavě bílá pevná látka.
V přírodě se nachází v minerálu fluorit nebo kazivec. Přirozeně existuje v kostech a zubech. Minerál fluorit je hlavním zdrojem používaným k získávání dalších sloučenin fluoru.

Kromě toho CaFdva Používá se k prevenci zubních kazů, proto se přidává do materiálů používaných zubními lékaři k jejich léčbě. Ve skutečnosti se fluorid vápenatý přidává také do pitné vody (vody, kterou lze pít), aby obyvatelstvo mělo prospěch z jeho požití a čištění zubů..
CaFdva Používá se ve formě velkých krystalů v optických zařízeních a kamerách. Používá se také v malých zařízeních, která se používají k detekci toho, kolik osob bylo vystaveno radioaktivitě.
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Bod varu
- 3.5 Hustota
- 3.6 Index lomu
- 3.7 Rozpustnost
- 3.8 Chemické vlastnosti
- 4 Přítomnost v přírodě
- 5 použití
- 5.1 - Při získávání sloučenin fluoru
- 5.2 - V péči o zuby
- 5.3 - V čočkách pro optická zařízení
- 5.4 - V metalurgickém průmyslu
- 5.5 - V detektorech radioaktivity nebo nebezpečného záření
- 5.6 - Jiná použití
- 6 Reference
Struktura
CaF fluorid vápenatýdva je iontová sloučenina tvořená kationem vápníku Cadva+ a dva fluoridové anionty F-. Některé zdroje informací však naznačují, že jejich odkazy mají určitý kovalentní charakter.
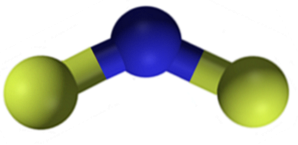
Nomenklatura
Fluorid vápenatý
Vlastnosti
Fyzický stav
Bezbarvá až šedobílá pevná látka se strukturou krychlového krystalu.
Molekulární váha
78,07 g / mol
Bod tání
1418 ° C
Bod varu
2533 ° C
Hustota
3,18 g / cm3 při 20 ° C.
Index lomu
1,4328
Rozpustnost
Je nerozpustný ve vodě při 20 ° C. Téměř nerozpustný při 25 ° C: 0,002 g / 100 ml vody. Mírně rozpustný v kyselinách.
Chemické vlastnosti
Jeho oxidační nebo redukční vlastnosti jsou velmi slabé, k těmto reakcím však může dojít. I když obecně, ve velmi málo případech.
Je inertní vůči organickým chemikáliím a mnoha kyselinám, včetně HF kyseliny fluorovodíkové. Rozpouští se pomalu v kyselině dusičné HNO3.
Není hořlavý. Nereaguje rychle se vzduchem nebo vodou.
Díky své nízké afinitě k vodě, i když je vystaven vysokému procentu vlhkosti, na ni nepůsobí ani po dobu jednoho měsíce při normální pokojové teplotě..
Za přítomnosti vlhkosti se stěny jeho krystalů pomalu rozpouštějí při teplotách nad 600 ° C. V suchém prostředí jej lze použít až do asi 1 000 ° C, aniž by to bylo znatelně ovlivněno.
Přítomnost v přírodě
CaF fluorid vápenatýdva nachází se přirozeně v minerálu fluorit nebo kazivec.
Ačkoli CaFdva čistý je bezbarvý minerál fluorit, je často zbarvený přítomností elektronů zachycených v „dírách“ krystalické struktury.
Tento minerál je vysoce ceněn pro svůj skelný lesk a rozmanitost barev (fialová, modrá, zelená, žlutá, bezbarvá, hnědá, růžová, černá a červenooranžová). Říká se o něm „nejbarvenější minerál na světě“.





Fluorid vápenatý se také nachází v kostech v množství mezi 0,2 a 0,65% a také ve sklovině zubů v 0,33-0,59%.
Aplikace
- Při získávání sloučenin fluoru
Minerální fluorit CaFdva Je to celosvětový základní nebo většinový zdroj fluoru. Je to surovina pro přípravu téměř všech sloučenin fluoru.
Nejdůležitější z nich je kyselina fluorovodíková HF, ze které se připravují další fluorované sloučeniny. Fluoridový iont F- uvolňovaný z minerálu jeho reakcí s koncentrovanou kyselinou sírovou HdvaSW4:
CaFdva (pevná látka) + HdvaSW4 (kapalina) → CaSO4 (pevná látka) + 2 HF (plyn)
- V péči o zuby
CaF fluorid vápenatýdva je to prostředek k prevenci dutin. Za tímto účelem se používá k fluoridaci pitné vody (vody, kterou lze vypít).
Kromě toho nízké koncentrace fluoridu F- (řádově 0,1 dílu na milion) používaných v zubních pastách a ústních vodách má zásadní pozitivní účinek na preventivní péči o zuby v dutinách.

Nanočástice CaFdva více efektivní
Ačkoli se fluoridy používají v zubních pastách a oplachech, nízká koncentrace vápníku (Ca) ve slinách znamená, že se netvoří usazeniny CaF.dva na zuby co nejúčinněji.
Proto byl navržen způsob, jak získat prášek CaF.dva jako nanočástice.
K tomu se používá rozprašovací sušička (z angličtiny rozprašovací sušička) kde dva roztoky (jeden z hydroxidu vápenatého Ca (OH)dva a jeden z fluoridu amonného NH4F) se smíchají při postřiku v komoře proudem horkého vzduchu.
Pak dojde k následující reakci:
Ca (OH)dva + NH4F → CaFdva (pevná látka) + NH4Ach
NH4OH těká jako NH3 a HdvaNebo a nanočástice CaF zůstanoudva.
Mají vysokou reaktivitu a větší rozpustnost, což je činí efektivnějšími pro remineralizaci zubů a jako protikorozní prostředky.
- V čočkách pro optická zařízení
Fluorid vápenatý se používá k výrobě optických prvků, jako jsou hranoly a okna infračervených a ultrafialových (UV) světelných spektrofotometrů..
Tato zařízení nám umožňují měřit množství světla absorbovaného materiálem při jeho průchodu.
CaFdva je transparentní v těchto oblastech světelného spektra, má extrémně nízký index lomu a umožňuje efektivnější rozlišení než NaCl v rozmezí 1 500–4 000 cm.-1.
Díky své chemické stabilitě odolává nepříznivým podmínkám, a proto optické prvky CaFdva nejsou napadeni. Má také vysokou tvrdost.
Ve kamerách
Někteří výrobci fotoaparátů používají objektivy CaFdva umělé krystalizace ke snížení rozptylu světla a dosažení vynikající korekce zkreslení barev.

- V metalurgickém průmyslu
CaFdva Používá se jako tavidlo v metalurgickém průmyslu, protože je zdrojem vápníku nerozpustného ve vodě, a proto je účinný v aplikacích citlivých na kyslík..
Používá se k tavení a zpracování železa a oceli v kapalné formě. To je založeno na skutečnosti, že má bod tání podobný jako železo a také to, že může rozpouštět oxidy a kovy..
- V detektorech radioaktivity nebo nebezpečného záření
CaFdva je to termoluminiscenční materiál. To znamená, že může absorbovat záření v elektronech své krystalické struktury a později, při zahřátí, ho uvolnit ve formě světla..
Toto emitované světlo lze měřit elektrickým signálem. Tento signál je úměrný množství záření, které materiál přijal. To znamená, že čím větší je množství přijímaného záření, tím větší je množství světla, které bude emitovat po zahřátí..
Z tohoto důvodu CaFdva Používá se v takzvaných osobních dozimetrech, které používají lidé, kteří jsou vystaveni nebezpečnému záření a chtějí vědět, kolik záření za určitou dobu přijali.
- Jiná použití
- Používá se jako katalyzátor při dehydratačních a dehydrogenačních chemických reakcích pro syntézu organických sloučenin.
- Používá se v alkalických svařovacích elektrodách. Získá se silnější svar než u kyselých elektrod. Tyto elektrody jsou užitečné při výrobě lodí a vysokotlakých ocelových nádob..
- Jako doplněk stravy v extrémně nízkých množstvích (ppm nebo části na milion).

Reference
- Pirmoradian, M. a Hooshmand, T. (2019). Remineralizace a antibakteriální schopnosti dentálních nanokompozitů na bázi pryskyřice. Syntéza a charakterizace fluoridu vápenatého (CaFdva). In Aplikace nanokompozitních materiálů ve stomatologii. Obnoveno ze sciencedirect.com.
- NÁS. Národní lékařská knihovna. (2019). Fluorid vápenatý. Obnoveno z pubchem.ncbi.nlm.nih.gov.
- Weman, K. (2012). Ruční svařování elektrickým obloukem (MMA) potaženými elektrodami. V příručce Procesy svařování (druhé vydání). Obnoveno ze sciencedirect.com.
- Hanning, M. a Hanning, C. (2013). Nanobiomateriály v preventivním zubním lékařství. Nanosovaný fluorid vápenatý. In Nanobiomaterials in Clinical Dentistry. Obnoveno ze sciencedirect.com.
- Ropp, R.C. (2013). Skupina 17 (H, F, Cl, Br, I) sloučeniny alkalických zemin. Fluorid vápenatý. In Encyclopedia of the Alkaline Earth Compounds. Obnoveno ze sciencedirect.com.
- Cotton, F. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chemie. Čtvrté vydání. John Wiley & Sons.
- Valkovic, V. (2000). Měření radioaktivity. In Radioactivity in the Environment. Termoluminiscenční detektory (TLD). Obnoveno ze sciencedirect.com.



Zatím žádné komentáře