
Molekulární vzorec, jak jej získat, příklady a cvičení
The molekulární vzorec Jde o reprezentaci molekuly sloučeniny, ve které jsou atomy všech prvků přítomných ve sloučenině a jejich počet označeny chemickými symboly. Každý atom je doprovázen dolním indexem.
Molekulární vzorec má omezení, že neindikuje vazby různých atomů molekuly ani jejich prostorový vztah; jak to dělá strukturální vzorec. V některých případech to není konkrétní, například: C6H12NEBO6 je molekulární vzorec glukózy, galaktózy a fruktózy.
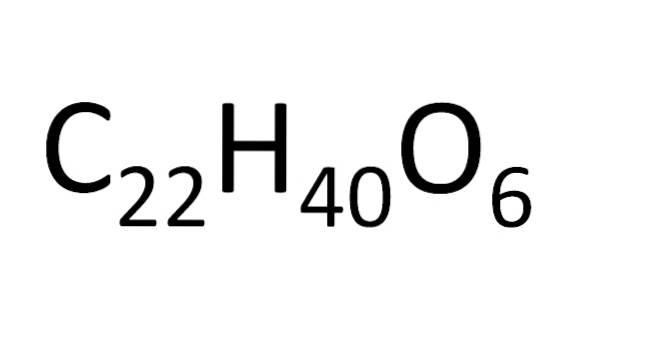
Existuje uspořádání pravidel pro uspořádání atomů v molekulárním vzorci. U iontových solí, například chloridu sodného, je symbol kationtu (Na+) a poté anionový symbol (Cl-). Proto je molekulární vzorec chloridu sodného NaCl.
Molekulární vzorec organických sloučenin se píše tak, že se nejprve umístí symbol pro uhlík (C), poté symbol pro vodík (H) a poté zbývající atomy. Například molekulární vzorec kyseliny octové je CdvaH4NEBOdva.
Rejstřík článků
- 1 Jak získat molekulární vzorec
- 1.1 První krok
- 1.2 Druhý krok
- 1.3 Třetí krok
- 1.4 Čtvrtý krok
- 1.5 Pátý krok
- 2 Příklady molekulárních vzorců
- 3 Vyřešená cvičení
- 3.1 - Cvičení 1
- 3.2 - Cvičení 2
- 4 Odkazy
Jak získat molekulární vzorec
Získání molekulárního vzorce sloučeniny je založeno na předchozím stanovení jejího minimálního nebo empirického vzorce. Z tohoto důvodu jsou počáteční kroky při získávání obou vzorců společné..
První krok
Je obvyklé vyjádřit hmotnost prvků chemické sloučeniny v procentech. Poté musí být proveden jednoduchý výpočet k transformaci hmotnostních procent různých prvků na jejich hmotnosti vyjádřené v gramech..
Druhý krok
Znalost hmotnosti každého z prvků v gramech a jejich atomové hmotnosti, relativního počtu každého atomu nebo počtu molů každého atomu lze získat dělením hmotnosti každého z různých prvků jejich atomovou hmotou..
Třetí krok
Vydělte relativní počet každý atomy, zadejte relativní počet menších hodnot. Hodnoty minimálního podílu musí být celá čísla. V případě, že hodnota podílu obsahuje desetinné místo, je třeba provést opravu, aby toto desetinné místo zmizelo.
Oprava spočívá v vynásobení všech hodnot poměru číslem, které vrátí všechna čísla ke všem hodnotám. Například pokud je hodnota minimálního podílu 1,25, všechny hodnoty musí být vynásobeny čtyřmi (4). Protože 1,25 krát 4 se rovná 5, celé číslo.
Čtvrtý krok
Budou umístěny všechny chemické symboly prvků sloučeniny a jejich odpovídající dolní index; tj. hodnota minimálního podílu prvku.
Pátý krok
Minimální vzorec sloučeniny lze převést na její molekulární vzorec získáním poměru mezi molekulovou hmotností sloučeniny a hmotností jejího minimálního vzorce (n). Tento vztah je stejný, jaký existuje mezi molekulárním vzorcem a minimálním vzorcem.
n = molekulová hmotnost sloučeniny / hmotnost minimálního vzorce
Pro získání molekulárního vzorce musí být minimální vzorec vynásoben n. To znamená, že každý z indexů minimálního vzorce musí být vynásoben n.
n = molekulová hmotnost / minimální hmotnost vzorce
= Molekulární vzorec / minimální vzorec
Molekulární vzorec = minimální vzorec
Příklady molekulárních vzorců
Některé běžné molekulární vzorce jsou uvedeny níže:
-Oxid železnatý (FeO)
-Hydroxid sodný (NaOH)
-Oxid draselný (K.dvaNEBO)
-Oxid chloritý (CldvaNEBO7)
-Hydroxid železitý [Fe (OH)3]
-Chlorid vápenatý (CaCldva)
-Kyselina chlorovodíková (HCl)
-Síran sodný (NdvaSW4)
-Kyselina sírová (HdvaSW4)
-Kyselina perbromová (HBrO4)
-Chlorid hlinitý (AlCl3)
-Metan (CH4)
-Propan (C.3H8)
-Ethan (C.dvaH6)
-Ethylalkohol (C.dvaH6NEBO)
-Kyselina octová (CdvaH4NEBOdva)
-Benzen (C.6H6)
-Glukóza (C6H12NEBO6)
Vyřešená cvičení
- Cvičení 1
Methylbenzoát má následující hmotnostní procenta:
C: 70,57%,
H: 5,93%
Nebo: 23,49%
A molekulová hmotnost 136,1 g / mol. Určete molekulární vzorec.
První krok
Prvním krokem je vyjádření hmotnostních procent prvků v jejich hmotnostech v gramech s vědomím, že hmotnostní procenta jsou ve vztahu k molekulové hmotnosti..
Ze 136,1 gramů, což odpovídá molu sloučeniny, představuje 70,57% pouze uhlík. A tak dále se zbývajícími prvky:
Uhlíková hmotnost = 136,1 g (70,57 / 100)
= 96,05 g
Hmotnost vodíku = 136,1 g (5,93 / 100)
= 8,06 g
Hmotnost kyslíku = 136,1 (23,49 / 100)
= 31,96 g
Druhý krok
Při zpracování molekulárního vzorce musí být stanoven relativní počet atomů (NRA). Za tímto účelem se hmotnosti prvků dělí jejich atomovými hmotnostmi:
NRA (C) = 96 g / 12 g
= 8
NRA (H) = 8 g / 1 g
= 8 g
NRA (O) = 32 g / 16 g
= 2
Třetí krok
Poté musíme vypočítat minimální proporce prvků (PME). Za tímto účelem jsou všechny hodnoty NRA vyděleny nejnižší hodnotou NRA:
PME (C) = 8/2
= 4
PME (H) = 8/2
= 4
PME (O) = 2/2
= 1
Čtvrtý krok
Napište minimální vzorec pro methylbenzoát na základě skutečnosti, že dolní indexy prvků jsou jejich vypočtené minimální podíly:
C4H4NEBO
Pátý krok
Nakonec musí být stanoven molekulární vzorec methylbenzoátu. Proto vypočítáme n:
n = molekulová hmotnost / minimální hmotnost vzorce
Hmotnost minimálního vzorce je 68 g / mol:
= 136,1 g / 68 g
n ≈ 2
Molekulární vzorec = 2minimální vzorec
= 2 ° C4H4NEBO
Molekulární vzorec methylbenzoátu = C8H8NEBOdva
- Cvičení 2
Procentní podíl prvků, které tvoří benzen, je následující:
C: 92,36%
H: 7,64%.
Molekulová hmotnost benzenu je 78 g / mol. Určete svůj molekulární vzorec.
První krok
Transformujte hmotnostní procenta prvků na jejich hmotnosti v gramech:
Uhlíková hmotnost = 78 g (92,36 / 100)
= 72,04 g
Hmotnost vodíku = 78 g (7,64 / 100)
= 5,96 g
Druhý krok
Výpočet relativního počtu atomů (NRA). Za tímto účelem se hmotnosti prvků dělí jejich atomovými hmotnostmi:
NRA (C) = 72 g / 12 g
= 6
NRA (H) = 6 g / 1 g
= 6
Třetí krok
Výpočet hodnot minimálního podílu prvků (PME). To se vypočítá vydělením hodnot NRA všech položek nejmenší hodnotou NRA:
PME (C) = 6/6
= 1
PME (H) = 6/6
= 1
Čtvrtý krok
Psaní minimálního vzorce pro benzen, s přihlédnutím k tomu, že dolní indexy prvků jsou hodnoty vypočteného minimálního podílu.
Minimální vzorec benzenu: CH
Pátý krok
Stanovení molekulárního vzorce výpočtem vztahu mezi molekulovou hmotností a hmotností minimálního vzorce:
n = Molekulová hmotnost / hmotnost minimálního vzorce
= 78 g / 13 g
n = 6
Molekulární vzorec = minimální vzorec
= 6CH
= C6H6
Reference
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Wikipedia. (2020). Chemický vzorec. Obnoveno z: en.wikipedia.org
- Neomezené učení. (s.f.). Molekulární vzorce. Obnoveno z: courses.lumenlearning.com
- Helmenstine, Anne Marie, Ph.D. (29. září 2019). Vypočítejte empirické a molekulární vzorce. Obnoveno z: thoughtco.com
- Peter J. Mikulecký, Chris Hren. (2020). Jak používat empirické vzorce k nalezení molekulárních vzorců. Obnoveno z: dummies.com



Zatím žádné komentáře