
Struktura, vlastnosti a použití peroxidu barnatého (BaO2)

The peroxid barnatý je iontová a anorganická sloučenina, jejíž chemický vzorec je BaOdva. Jako iontová sloučenina se skládá z iontů Badva+ mědvadva-; ten druhý je známý jako peroxidový anion a díky tomu BaOdva získává své jméno. To je případ, BaOdva je anorganický peroxid.
Náboje jeho iontů odhalují, jak je tato sloučenina tvořena z prvků. Kov barnatý skupiny 2 dává dva elektrony molekule kyslíku, Odva, jejichž atomy se nepoužívají k redukci na oxidové anionty, NEBOdva-, ale být držen pohromadě jednoduchým odkazem, [O-O]dva-.

Peroxid barnatý je zrnitá pevná látka při pokojové teplotě, bílé barvy s mírnými šedivými tóny (horní obrázek). Stejně jako téměř všechny peroxidy je třeba s ním zacházet a uchovávat jej opatrně, protože může urychlit oxidaci určitých látek.
Ze všech peroxidů vytvořených kovy skupiny 2 (pan Becambara), BaOdva je termodynamicky nejstabilnější proti svému tepelnému rozkladu. Při zahřátí uvolňuje kyslík a vzniká oxid barnatý, BaO. BaO může reagovat s kyslíkem v prostředí při vysokých tlacích a znovu vytvářet BaOdva.
Rejstřík článků
- 1 Struktura
- 1.1 Energie krystalové mřížky
- 1.2 Hydráty
- 2 Příprava nebo syntéza
- 3 Vlastnosti
- 3.1 Fyzický vzhled
- 3.2 Molekulová hmotnost
- 3.3 Hustota
- 3.4 Bod tání
- 3.5 Bod varu
- 3.6 Rozpustnost ve vodě
- 3.7 Tepelný rozklad
- 4 Názvosloví
- 5 použití
- 5.1 Výrobce kyslíku
- 5.2 Výrobce peroxidu vodíku
- 6 Reference
Struktura
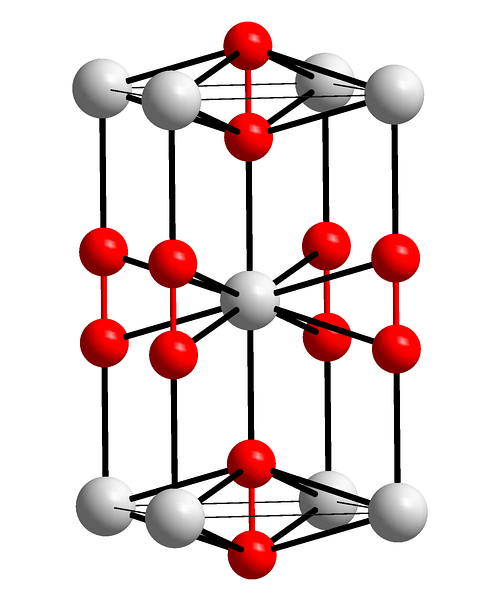
Horní obrázek ukazuje tetragonální jednotkovou buňku peroxidu barnatého. Uvnitř je vidět kationty Badva+ (bílé koule) a anionty Odvadva- (červené koule). Všimněte si, že červené koule jsou spojeny jedinou vazbou, takže představují lineární geometrii [O-O]dva-.
Z této jednotkové buňky lze postavit krystaly BaOdva. Pokud je pozorován, anion Odvadva- je vidět, že je obklopen šesti Badva+, získání osmistěnu, jehož vrcholy jsou bílé.
Na druhou stranu, ještě evidentnější, každá Badva+ je obklopen deseti Odvadva- (bílá koule uprostřed). Celý krystal sestává z této konstantní objednávky krátkého a dlouhého dosahu.
Energie krystalové mřížky
Pokud jsou pozorovány také červené bílé koule, je třeba poznamenat, že se příliš neliší ve svých velikostech nebo iontových poloměrech. Je to proto, že Ba kationdva+ je velmi objemný a jeho interakce s aniontem Odvadva- stabilizovat mřížkovou energii krystalu na lepší úroveň ve srovnání s tím, jak by to činily například kationty Ca.dva+ a Mgdva+.
To také vysvětluje, proč je BaO nejstabilnější z oxidů alkalických zemin: Ba ionty.dva+ mědva- se značně liší velikostí, což destabilizuje jejich krystaly.
Protože je nestabilnější, tím nižší je trend BaOdva rozkládající se za vzniku BaO; na rozdíl od peroxidů SrOdva, CaOdva a MgOdva, jejichž oxidy jsou stabilnější.
Hydráty
BaOdva lze nalézt ve formě hydrátů, z nichž BaOdva∙ 8HdvaNebo je nejstabilnější ze všech; a ve skutečnosti je to ten, který se prodává místo bezvodého peroxidu barnatého. Pro získání bezvodého se BaO musí sušit při 350 ° Cdva∙ 8HdvaNebo za účelem odstranění vody.
Jeho krystalová struktura je také tetragonální, ale s osmi molekulami HdvaO interakce s Odvadva- vodíkovými vazbami a Badva+ interakcemi dipól-ion.
Jiné hydráty, o jejichž strukturách není v tomto ohledu mnoho informací, jsou: BaOdvaH 10 hodindvaO, BaOdva∙ 7HdvaO a BaOdva∙ HdvaNEBO.
Příprava nebo syntéza
Přímá příprava peroxidu barnatého spočívá v oxidaci jeho oxidu. To lze použít z minerálního barytu nebo z dusičnanové soli barnatého, Ba (NO3)dva; oba jsou zahřívány ve vzduchu nebo v atmosféře obohacené kyslíkem.
Další metoda spočívá v reakci Ba (NO3)dva s peroxidem sodným:
Koupel3)dva + NadvaNEBOdva + xHdvaO => BaOdva∙ xHdvaO + 2NaNO3
Pak hydratujte BaOdva∙ xHdvaNebo je vystaven zahřívání, filtrován a dokončen sušením ve vakuu.
Vlastnosti
Fyzický vzhled
Je to bílá pevná látka, která může mít šedou barvu, pokud má nečistoty (buď BaO, Ba (OH)dva, nebo jiné chemické druhy). Pokud se zahřeje na velmi vysokou teplotu, bude v důsledku elektronických přechodů Ba kationtů vydávat nazelenalé plameny.dva+.
Molekulová hmotnost
169,33 g / mol.
Hustota
5,68 g / ml.
Bod tání
450 ° C.
Bod varu
800 ° C Tato hodnota odpovídá tomu, co lze očekávat od iontové sloučeniny; a ještě více, nejstabilnějšího peroxidu alkalických zemin. BaO však ve skutečnosti nevarujedva, spíše se plynný kyslík uvolňuje v důsledku jeho tepelného rozkladu.
Rozpustnost ve vodě
Nerozpustný. Může však pomalu podstoupit hydrolýzu za vzniku peroxidu vodíku, HdvaNEBOdva; a dále se jeho rozpustnost ve vodném prostředí zvyšuje, pokud se přidá zředěná kyselina.
Tepelný rozklad
Následující chemická rovnice ukazuje reakci tepelného rozkladu, kterou BaO procházídva:
2BaOdva <=> 2BaO + Odva
Reakce je jednosměrná, pokud je teplota nad 800 ° C. Pokud se tlak okamžitě zvýší a teplota klesne, všechny BaO se transformují zpět na BaOdva.
Nomenklatura
Další způsob, jak pojmenovat BaOdva podle tradiční nomenklatury je to peroxid barnatý; protože barium může mít ve svých sloučeninách pouze valenci +2.
Špatně se systematická nomenklatura používá k jeho označení jako oxidu barnatého (binoxidu), přičemž je považován za oxid a nikoli za peroxid.
Aplikace
Výrobce kyslíku
Pomocí minerálního barytu (BaO) se ohřívá proudy vzduchu, aby se eliminoval jeho obsah kyslíku, při teplotě kolem 700 ° C..
Pokud se výsledný peroxid jemně zahřívá ve vakuu, kyslík se regeneruje rychleji a baryt lze opakovaně použít k ukládání a výrobě kyslíku..
Tento proces komerčně vymyslel L. D. Brin, nyní zastaralý.
Výrobce peroxidu vodíku
Peroxid barnatý reaguje s kyselinou sírovou za vzniku peroxidu vodíku:
Paprsekdva + HdvaSW4 => HdvaNEBOdva + Baso4
Je tedy zdrojem HdvaNEBOdva, manipulováno zejména s jeho hydrátem BaOdva∙ 8HdvaNEBO.
Podle těchto dvou zmíněných použití je BaOdva umožňuje vývoj Odva a HdvaNEBOdva, jak oxidační činidla, v organické syntéze, tak v bělících procesech v textilním a barvivovém průmyslu. Je to také dobrý dezinfekční prostředek..
Dále od BaOdva mohou být syntetizovány další peroxidy, jako je sodík, NadvaNEBOdva, a další soli barya.
Reference
- S.C. Abrahams, J. Kalnajs. (1954). Krystalová struktura peroxidu barnatého. Laboratoř pro izolační výzkum, Massachusetts Institute of Technology, Cambridge, Massachusetts, USA.
- Wikipedia. (2018). Peroxid barnatý. Obnoveno z: en.wikipedia.org
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Atomistry. (2012). Peroxid barnatý. Obnoveno z: barium.atomistry.com
- Khokhar a kol. (2011). Studium přípravy laboratorního měřítka a vývoj procesu pro peroxid barnatý. Obnoveno z: academia.edu
- PubChem. (2019). Peroxid barnatý. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- PrebChem. (2016). Příprava peroxidu barnatého. Obnoveno z: prepchem.com


Zatím žádné komentáře