
Historie fosforu, vlastnosti, struktura, získávání, použití
The zápas Jedná se o nekovový prvek, který je reprezentován chemickým symbolem P a má atomové číslo 15. Má tři hlavní alotropní formy: bílý, červený a černý fosfor. Bílý fosfor je fosforeskující, při vystavení vzduchu spontánně hoří a je také vysoce jedovatý..
Z bílého fosforu se při teplotě 250 ° C stane červený fosfor; nerozpustná polymerní forma, která nehoří na vzduchu. Při vysokých teplotách a tlacích, stejně jako v přítomnosti katalyzátorů nebo bez nich se získává černý fosfor, který se podobá grafitu a je dobrým vodičem elektřiny..

Fosfor byl poprvé izolován H. Brandem v roce 1669. K tomu použil jako zdroj tohoto prvku moč. V roce 1770 W. Scheele zjistil, že může také izolovat fosfor z kostí.
Později, díky vytvoření elektrické pece J. Burgessem Readmanem (1800), se fosfátové horniny staly hlavním zdrojem produkce fosforu z minerálu fluoroapatit, který je v nich obsažen..
Fosfor je dvanáctý nejhojnější prvek v zemské kůře a představuje 0,1% hmotnosti. Kromě toho je v lidském těle hojným šestým prvkem; koncentruje se hlavně v kostech ve formě hydroxylapatitu.
Je tedy základním prvkem živých bytostí a stává se jednou ze tří hlavních živin rostlin. Fosfor je součástí chemické struktury nukleových kyselin; energetických zásobních sloučenin (ATP), koenzymy; a obecně sloučenin metabolismu.
Rejstřík článků
- 1 Historie
- 1.1 - Objev
- 1.2 - Průmyslový rozvoj
- 2 Fyzikální a chemické vlastnosti
- 2.1 Vzhled
- 2.2 Atomová hmotnost
- 2.3 Atomové číslo (Z)
- 2.4 Teplota tání
- 2.5 Bod varu
- 2.6 Hustota (pokojová teplota)
- 2.7 Fúzní teplo
- 2.8 Odpařovací teplo
- 2.9 Molární tepelná kapacita
- 2.10 oxidační stavy
- 2.11 Elektronegativita
- 2.12 Ionizační energie
- 2.13 Tepelná vodivost
- 2.14 Magnetické pořadí
- 2.15 Izotopy
- 2.16 Fosforescence
- 2.17 Allotropické změny
- 2.18 Rozpustnost
- 2.19 Reaktivita
- 3 Struktura a elektronická konfigurace
- 3.1 - Odkazy a čtyřboká jednotka
- 3.2 - Allotropes
- 4 Kde najít a získat
- 4.1 Apatit a fosforit
- 4.2 Elektrotermická redukce fluoroapatitu
- 5 slitin
- 5.1 Měď
- 5.2 Bronz
- 5.3 Poniklované
- 6 Rizika
- 7 použití
- 7.1 - Elementární fosfor
- 7.2 - Sloučeniny
- 8 Reference
Příběh
- Objev
V moči

Fosfor byl izolován Henningem Brandem v roce 1669 a byl prvním člověkem, který izoloval prvek. Brand byl německý alchymista z Hamburku a podařilo se mu získat sloučeninu fosforu z moči. Za tímto účelem shromáždil moč z 50 kbelíků a nechal ji rozložit.
Brand poté odpařil moč a získal načernalý zbytek, který několik měsíců uchovával. K tomu přidal písek a zahřál ho, čímž dokázal eliminovat plyny a oleje. Nakonec získal bílou pevnou látku, která ve tmě zářila zelenou barvou, kterou nazýval „studený oheň“..
Termín „fosfor“, shodou okolností pochází z řeckého slova „Phosphoros“, což znamená nosič světla..
Brand nezveřejnil své experimentální výsledky a prodal je různým alchymistům, včetně: Johanna Krafta, Kunckela Lowensterna a Wilhelma Leibnize. Pravděpodobně někteří z nich ohlásili Brandovu práci Pařížské akademii věd, čímž rozšířili svůj výzkum.
Značka však ve skutečnosti neizolovala fosfor, ale fosforečnan sodný amoniak [Na (NH4) PO4]. V roce 1680 Robert Boyle vylepšil Brandův postup, kterým se mu podařilo získat alotropickou formu fosforu (P4).
V kostech
Johan Gottlieb Gahn a Carl Wihelm Scheele založili v roce 1769, že v kostech byla nalezena sloučenina fosforu, fosforečnan vápenatý. Odtučněné kosti byly podrobeny procesu trávení silnými kyselinami, jako je kyselina sírová.
Poté byl produkt štěpení zahříván v ocelových nádobách s uhlím a uhlím, čímž byl získán bílý fosfor destilací v retortách. Kosti byly hlavním zdrojem fosforu až do roku 1840, kdy byly pro tento účel nahrazeny guanem..
V guanu
Guano je směs ptačího trusu a produktů rozkladu ptáků. V 19. století byl používán jako zdroj fosforu a hnojiv.
- Průmyslový rozvoj
Fosfátové horniny se začaly používat v roce 1850 jako zdroj fosforu. To spolu s vynálezem elektrické pece pro kalcinaci hornin od Jamese Burgesse Readmana (1888) učinilo z fosfátových hornin hlavní surovinu pro výrobu fosforu a hnojiv..
V roce 1819 byly založeny továrny na zápalky, které zahájily průmyslový rozvoj využívání fosforu..
Fyzikální a chemické vlastnosti
Vzhled
V závislosti na alotropní formě může být bezbarvá, voskovitě bílá, žlutá, šarlatová, červená, fialová nebo černá.
Atomová hmotnost
30 973 u
Atomové číslo (Z)
patnáct
Bod tání
Bílý fosfor: 44,15 ° C
Červený fosfor: ~ 590 ° C
Bod varu
Bílý fosfor: 280,5 ° C
Hustota (pokojová teplota)
Bílá: 1,823 g / cm3
Červená: 2,2-2,34 g / cm3
Fialová: 2,36 g / cm3
Černá: 2,69 g / cm3
Teplo fúze
Bílý fosfor: 0,66 kJ / mol
Odpařovací teplo
Bílý fosfor: 51,9 kJ / mol
Molární tepelná kapacita
Bílý fosfor: 23,824 J / (mol.K)
Oxidační stavy
-3, -2, -1, +1, +2, +3, +4 a +5
V závislosti na elektronegativitě prvků, se kterými se kombinuje, může fosfor vykazovat oxidační stav +3 nebo -3. Fosfor má na rozdíl od dusíku tendenci přednostně reagovat s oxidačním stavem +5; takový je případ oxidu fosforečného (PdvaNEBO5 nebo Pdva5+NEBO5dva+).
Elektronegativita
2,19 na Paulingově stupnici
Ionizační energie
-První: 1101 kJ / mol
-Za druhé: 2 190,7 kJ / mol
-Za třetí: 2914 kJ / mol
Tepelná vodivost
Bílý fosfor: 0,236 W / (mK)
Černý fosfor: 12,1 W / (mK)
Ukazuje, jak černý fosfor vede téměř šestkrát více tepla než bílý fosfor.
Magnetický řád
Bílé, červené, fialové a černé luminofory jsou diamagnetické.
Izotopy
Fosfor má 20 izotopů, z nichž hlavní jsou: 31P, jediný stabilní izotop s hojností 100%; 32P, β-emitující izotop- a s poločasem rozpadu 14,28 dne; Y 33P, β-emitující izotop- a s poločasem 25,3 dne.
Fosforescence
Bílý fosfor je fosforeskující a ve tmě vydává zelené světlo.
Allotropické změny
Bílý fosfor je nestálý a mění se při teplotách blízkých 250 ° C do polymerní formy známé jako červený fosfor, která se může pohybovat od oranžové po fialovou barvu. Je to amorfní látka, ale může se stát krystalickou; nesvítí ve tmě ani nehoří ve vzduchu.
Bílý fosfor se při vysokých teplotách a tlacích nebo v přítomnosti katalyzátorů transformuje do jiné polymerní formy než červený fosfor: černý fosfor. Jedná se o krystalickou látku černé barvy, inertní, podobnou grafitu, která má schopnost vést elektřinu.
Rozpustnost
Bílý fosfor v čisté formě je nerozpustný ve vodě, i když jej lze solubilizovat v sirníku uhlíku. Mezitím jsou červené a černé fosfory nerozpustné ve vodě a jsou méně těkavé než bílý fosfor..
Reaktivita
Fosfor spontánně hoří na vzduchu za vzniku PdvaNEBO5, a to zase může reagovat se třemi molekulami vody za vzniku kyseliny ortofosforečné nebo fosforečné (H3PO4).
Působením horké vody, fosfinu (PH3) a oxidy fosforu.
Kyselina fosforečná působí na fosfátové horniny a způsobuje dihydrogenfosforečnan vápenatý nebo superfosfát [Ca (HdvaPO4)dva].
Může reagovat s halogeny za vzniku halogenidů PX3, X představující F, Cl, Br nebo I; nebo halogenidy se vzorcem PX5, kde X je F, Cl nebo Br.
Fosfor také reaguje s kovy a metaloidy za vzniku fosfidů a se sírou za vzniku různých sulfidů. Na druhou stranu se váže na kyslík a vytváří estery. Stejným způsobem se kombinuje s uhlíkem za vzniku organických sloučenin fosforu..
Struktura a elektronická konfigurace
- Dluhopisy a čtyřboká jednotka
Atomy fosforu mají následující elektronickou konfiguraci:
[Ne] 3 sdva 3p3
Má tedy pět valenčních elektronů, jako je dusík a další prvky skupiny 15. Jelikož se jedná o nekovový prvek, musí jeho atomy vytvářet kovalentní vazby, dokud není valenční oktet dokončen. Dusík toho dosahuje tím, že se etabluje jako diatomické molekuly Ndva, s trojnou vazbou, N≡N.
Totéž se děje s fosforem: dva z jeho atomů P se spojí s trojnou vazbou za vzniku molekuly P.dva, P≡P; tj. difosforový allotrope. Fosfor má však vyšší atomovou hmotnost než dusík a jeho 3p orbitaly, difúznější než 2p dusíku, se překrývají méně efektivně; proto Pdva existuje pouze v plynném stavu.
Místo toho se při teplotě místnosti atomy P raději kovalentně organizují jiným způsobem: v čtyřboké molekule P4:

Všimněte si, že na horním obrázku mají všechny atomy P tři jednoduché vazby místo jedné trojné vazby. Fosfor v P.4 dokončí svůj valenční oktet. Avšak v P4 ve vazbách P-P je napětí, protože jejich úhly jsou daleko od 109,5 ° pouhým okem.
- Allotropes
Bílý fosfor
Stejný obrázek jednotek P.4 a jeho nestabilita vysvětluje, proč je bílý fosfor nejstabilnějším alotropem tohoto prvku.
Jednotky P4 jsou uspořádány v prostoru, aby definovaly krystal bcc (fáze α) za normálních podmínek. Když teplota klesne na -77,95 ° C, krystal bcc se transformuje na hustší hcp (pravděpodobně) (beta fáze). To znamená, že jednotky P4 jsou uspořádány ve dvou střídajících se vrstvách, A a B, aby vytvořily sekvenci ABAB ...
Červený fosfor
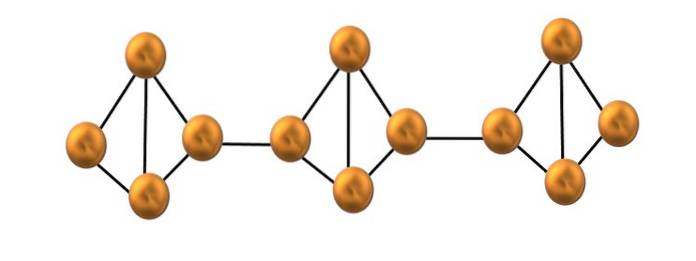
Na horním obrázku je zobrazen pouze malý segment struktury červeného fosforu. Jelikož jsou tři jednotky vyrovnány „symetricky“, lze říci, že se jedná o krystalickou strukturu, která se získá zahřátím tohoto fosforu nad 250 ° C..
Červený fosfor však většinu času sestává z amorfní pevné látky, takže jeho struktura je chaotická. Poté byly polymerní řetězce P4 by byly uspořádány bez zjevného vzoru, některé nad a jiné pod stejnou rovinou libovolně.
Všimněte si, že toto je hlavní strukturální rozdíl mezi bílým a červeným fosforem: v prvním případě P4 jsou individuální a ve druhém tvoří řetězce. To je možné, protože jedna z vazeb P-P uvnitř čtyřstěnu je přerušena, aby se navázala na sousední čtyřstěn. Tím se sníží prstencové napětí a červený fosfor získá větší stabilitu..
Pokud existuje směs obou alotropů, je nabídnuta oku jako žlutý fosfor; směs čtyřstěnů a amorfních řetězců fosforu. Ve skutečnosti se bílý fosfor při vystavení slunečnímu záření zbarví nažloutle, protože záření podporuje rozlomení již zmíněné vazby P-P..
Fialový nebo Hittorfův fosfor
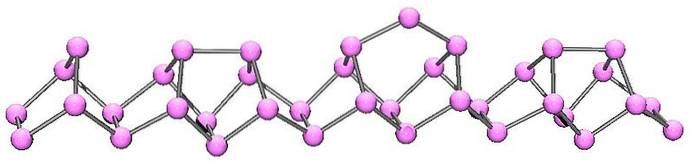
Fialový fosfor je konečným vývojem červeného fosforu. Jak je vidět na obrázku výše, stále se skládá z polymerního řetězce; ale nyní jsou struktury složitější. Zdá se, že strukturální jednotka již není P4 ale Pdva, uspořádány tak, aby vytvářely nepravidelné pětiúhelníkové prstence.
Navzdory tomu, jak asymetrická struktura vypadá, se těmto polymerním řetězcům podaří dostatečně dobře a s periodicitou zajistit, aby fialový fosfor vytvořil monoklinické krystaly..
Černý fosfor
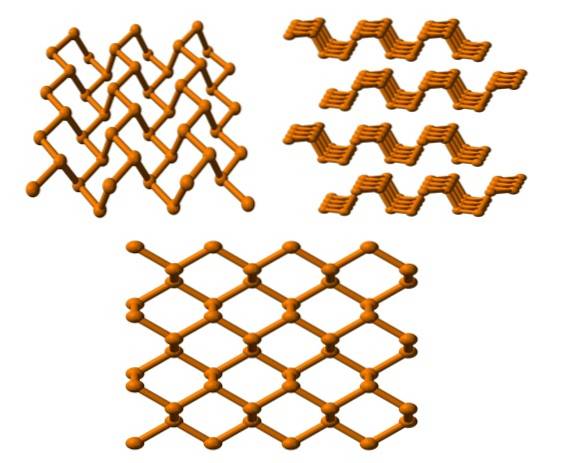
A konečně máme nejstabilnější alotopický fosfor: černý. Připravuje se zahříváním bílého fosforu pod tlakem 12 000 atm.
Na horním obrázku (níže) je vidět, že jeho struktura z vyšší roviny má určitou podobnost se strukturou grafitu; je strmá síť šestiúhelníkových prstenů (i když vypadají jako čtverce).
V levém horním rohu obrázku lze lépe ocenit to, co bylo právě komentováno. Molekulární okolí atomů P jsou trigonální pyramidy. Všimněte si, že struktura při pohledu ze strany (pravý horní roh) je uspořádána ve vrstvách, které zapadají jedna přes druhou.
Struktura černého fosforu je poměrně symetrická a uspořádaná, což odpovídá jeho schopnosti etablovat se jako ortorombické krystaly. Díky jejich polymerním vrstvám jsou atomy P nedostupné pro mnoho chemických reakcí; a proto je značně stabilní a málo reaktivní.
Ačkoli stojí za zmínku, některé jejich fyzikální vlastnosti řídí Londonovy disperzní síly a molární hmotnosti těchto fosforečných pevných látek; zatímco jejich struktury a vazby P-P definují chemické a další vlastnosti.
Kde najít a získat
Apatit a fosforit
Je to dvanáctý prvek zemské kůry a představuje 0,1% hmotnosti. Existuje asi 550 minerálů, které obsahují fosfor, apatit je nejdůležitějším minerálem pro získání fosforu..
Apatit je minerál z fosforu a vápníku, který může obsahovat různá množství fluoru, chloridu a hydroxidu, jehož vzorec je následující: [Ca10(PO4)6(F, Cl nebo OH)dva)]. Kromě apatitu existují i jiné minerály fosforu komerčního významu; takový je případ wavelita a vivianita.
Fosfátová hornina nebo fosforit jsou hlavním zdrojem fosforu. Jedná se o nedetritální sedimentární horninu, která má obsah fosforu 15-20%. Fosfor je obvykle přítomen jako Ca10(PO4)6Fdva (fluoroapatit). Je také přítomen jako hydroxyapatit, i když v menší míře.
Kromě toho lze fluoroapatit nalézt jako součást vyvřelých a metamorfovaných hornin, stejně jako vápenec a břidlice..
Elektrotermická redukce fluoroapatitu
Vybrané fosfátové horniny jsou přeneseny do čistírny ke zpracování. Zpočátku se drtí, aby se získaly kamenné úlomky, které se poté drtí v kulových mlýnech při 70 otáčkách za minutu.
Poté se produkt drcení úlomků horniny prosívá, aby je bylo možné frakcionovat. Frakce s obsahem fosforu 34% jsou vybrány jako oxid fosforečný (PdvaNEBO5).
Bílý fosfor (str4) se získává průmyslově elektrotermickou redukcí fluoroapatitu uhlíkem při teplotě 1 500 ° C v přítomnosti oxidu křemičitého:
2Ca3(PO4)dva(s) + 6SiOdva(s) + 10 ° C (s) => P4(g) + CaSiO3(l) + CO (g)
Str4 v plynném stavu se po kondenzaci shromažďuje a skladuje jako bílá pevná látka ponořená ve vodě, aby se zabránilo její reakci s vnějším vzduchem.
Slitiny
Měděný
Fosforová deka je vyráběna s různým procentem mědi a fosforu: Cu 94% - P 6%; Cu 92% - P 8%; Cu 85% - P 15% atd. Slitina se používá jako deoxidátor, smáčedlo pro průmysl mědi a také jako nukleant v průmyslu hliníku.
Broncíneas
Jsou to slitiny mědi, fosforu a cínu, které obsahují 0,5 - 11% fosforu a 0,01 - 0,35% cínu. Cín zvyšuje odolnost proti korozi, zatímco fosfor zvyšuje odolnost slitiny proti opotřebení a dodává jí tuhost.
Používá se při výrobě pružin, šroubů a obecně u předmětů, které vyžadují odolnost proti únavě, opotřebení a chemické korozi. Jeho použití se doporučuje u vrtulí člunů.
Poniklované
Nejznámější slitinou je NiPdvacet, použití fosfor niklu ve slitinách pro tvrdé pájení ke zlepšení jejich odolnosti proti chemické erozi, oxidaci a vysokým teplotám.
Slitina se používá v součástech plynových turbín a proudových motorů, při galvanickém pokovování a při výrobě svařovacích elektrod.
Rizika
Bílý fosfor způsobuje těžké popáleniny kůže a je silným jedem, který může být při dávce 50 mg smrtelný. Fosfor inhibuje buněčnou oxidaci a narušuje řízení buněčného kyslíku, což může vést k tukové degeneraci a buněčné smrti.
Akutní otrava fosforem vyvolává během prvních čtyř dnů po požití bolesti břicha, pálení, dech páchnoucí česnekem, fosforeskující zvracení, pocení, svalové křeče a dokonce šokový stav..
Později žloutenka, petechie, krvácení, postižení myokardu s arytmiemi, změna centrálního nervového systému a smrt desátý den po požití..
Nejviditelnějším projevem chronické otravy fosforem je poškození kostní struktury čelisti.
Ke zvýšení koncentrace fosforu v plazmě (hyperfosfatémie) obvykle dochází u pacientů se selháním ledvin. To způsobuje abnormální ukládání fosfátů v měkkých tkáních, což může vést k vaskulární dysfunkci a kardiovaskulárním onemocněním..
Aplikace
Fosfor je základním prvkem pro rostliny a zvířata. Je to jedna ze tří hlavních živin rostlin, která je nezbytná pro jejich růst a energetické nároky. Kromě toho je součástí nukleových kyselin, fosfolipidů, meziproduktů metabolických procesů atd..
U obratlovců je fosfor přítomen v kostech a zubech ve formě hydroxylapatitu..
- Elementární fosfor

S fosforem se vyrábí chemický smalt, který se používá k osvětlení značek umístěných na hliníku a jeho slitinách; stejně jako fosfor měď a bronz.
Používá se také k výrobě zápalných bomb, granátů, kouřových bomb a stopovacích střel. Červený fosfor se používá k výrobě zápalek nebo bezpečnostních zápalek.
Z bílého fosforu se vyrábí organofosfáty. Kromě toho se používá při výrobě kyseliny fosforečné.
Velké množství vyrobeného fosforu se spaluje za účelem výroby oxidu fosforečného (P4NEBO10), získané ve formě prášku nebo pevné látky.
- Sloučeniny
Fosfin
Je to surovina pro výrobu různých sloučenin fosforu. Působí jako dopingový prostředek pro elektronické součástky.
Kyselina fosforečná
Používá se při výrobě nealkoholických nápojů díky charakteristické příchuti, kterou jim dodává. Působí na fosfátové horniny za vzniku dihydrogenfosforečnanu vápenatého [Ca (HdvaPO4)dva], známý také jako superfosfát, který se používá jako hnojivo.
Kyselina fosforečná je kondicionujícím prvkem zubní skloviny pro usnadnění adheze vašich restaurátorských materiálů. Používá se také ve směsi s olejem, močovinou, dehtem, asfaltem a pískem za vzniku asfaltu; materiál používaný při opravách pozemních komunikačních tras.
Organofosfáty
Organofosfátové sloučeniny mají mnoho aplikací; jako: zpomalovače hoření, pesticidy, extrakční činidla, nervově působící látky a pro úpravu vody.
Dihydrogenfosforečnan vápenatý dihydrát
Používá se jako hnojivo, prášek do pečiva, přísada do krmiva pro zvířata a při výrobě zubních past.
Oxid fosforečný
Používá se v chemické analýze jako dehydratační činidlo a v organické syntéze jako kondenzační činidlo. Tato sloučenina je primárně určena k výrobě kyseliny ortofosforečné.
Tripolyfosforečnan sodný
Používá se v detergentech a jako změkčovač vody, který zlepšuje působení detergentů a pomáhá předcházet korozi potrubí.
Fosforečnan sodný
Používá se jako čisticí prostředek a změkčovač vody.
Fosforečnany sodné
Hydrogenfosforečnan sodný (NadvaHPO4) a jednosytný fosforečnan sodný (NaHdvaPO4) jsou součástmi pufrovacího systému pH, který dokonce působí na živé bytosti; včetně lidských bytostí.
Reference
- Reid Danielle. (2019). Allotropy fosforu: Formy, použití a příklady. Studie. Obnoveno z: study.com
- Prof. Robert J. Lancashire. (2014). Přednáška 5c. Struktura prvků, pokračování P, S a I. Obnoveno z: chem.uwimona.edu.jm
- BYJU'S. (2019). Červený fosfor. Obnoveno z: byjus.com
- Bing Li, Ceng-Ceng Ren, Shu-Feng Zhang a kol. (2019). Elektronické strukturní a optické vlastnosti vícevrstvého modrého fosforu: studie prvního principu. Journal of Nanomaterials, sv. 2019, ID článku 4020762, 8 stránek. doi.org/10.1155/2019/4020762
- Dr. Těsto Stewar. (2019). Fakta o prvcích fosforu. Chemicool. Obnoveno z: chemicool.com
- Wikipedia. (2019). Fosfor. Obnoveno z: en.wikipedia.org
- Helmenstine, Anne Marie, Ph.D. (3. července 2019). Fakta o fosforu (atomové číslo 15 nebo symbol prvku P). Obnoveno z: thoughtco.com
- Institut Linuse Paulinga. (2019). Fosfor. Obnoveno z: lpi.oregonstate.edu
- Bernardo Fajardo P. & Héctor Lozano V. (s.f.). Národní zpracování fosfátových hornin pro výrobu superfosfátů. [PDF]. Obnoveno z: bdigital.unal.edu.co
- Redaktoři Encyclopaedia Britannica. (16. listopadu 2018). Chemický prvek fosforu. Encyklopedie Britannica. Obnoveno z: britannica.com
- Reade International Corp. (2018). Slitina mědi fosforu (CuP). Obnoveno z: reade.com
- KBM Affilips. (27. prosince 2018). Hlavní slitina niklu a fosforu (NiP). AZoM. Obnoveno z: azom.com
- Lenntech B.V. (2019). Periodická tabulka: fosfor. Obnoveno z: lenntech.com
- Abhijit Naik. (2018, 21. února). Použití fosforu. Obnoveno z: sciencestruck.com


Zatím žádné komentáře