
Struktura, vlastnosti a použití heptanu (C7H16)
The heptan je organická sloučenina, jejíž chemický vzorec je C7H16 a obsahuje devět strukturních izomerů, z nichž nejznámější je lineární. Jedná se o uhlovodík, konkrétně o alkan nebo parafín, který se nachází ve většině laboratoří organické chemie, ať už ve výuce nebo výzkumu..
Na rozdíl od jiných parafinických rozpouštědel má heptan nižší těkavost, díky čemuž je jeho použití relativně bezpečnější; za předpokladu, že kolem vašich par není žádný zdroj tepla a pracujete uvnitř digestoře. Když vynecháme jeho hořlavost, je to sloučenina dostatečně inertní, aby sloužila jako médium pro organické reakce..
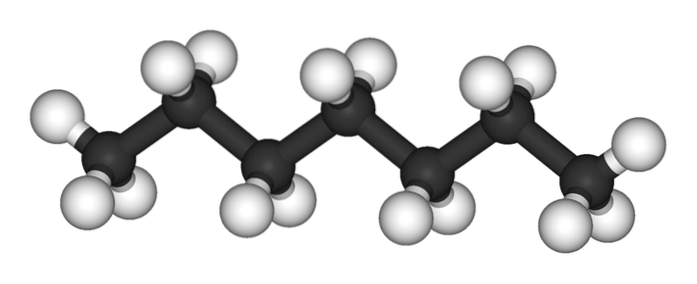
Horní obrázek ukazuje strukturu n-heptan, lineární izomer všech heptanů. Protože se jedná o nejběžnější a komerčně nejcennější izomer a také nejsnadnější syntézu, je třeba chápat, že výraz „heptan“ označuje výhradně n-heptan; Pokud není uvedeno jinak.
Láhve této kapalné sloučeniny však specifikují, že obsahuje n-heptan. Musí být odkryty uvnitř digestoře a měření musí být provedeno pečlivě.
Je to vynikající rozpouštědlo pro tuky a oleje, a proto se často používá při extrakcích rostlinných esencí nebo jiných přírodních produktů..
Rejstřík článků
- 1 Struktura
- 1.1 n-heptan a jeho intermolekulární interakce
- 1.2 Izomery
- 2 Vlastnosti heptanu
- 2.1 Fyzický vzhled
- 2.2 Molární hmotnost
- 2.3 Bod tání
- 2.4 Bod varu
- 2.5 Tlak par
- 2.6 Hustota
- 2.7 Rozpustnost ve vodě
- 2.8 Rozpustnost v jiných rozpouštědlech
- 2.9 Index lomu (nD)
- 2.10 Viskozita
- 2.11 Tepelná kapacita
- 2.12 Bod vzplanutí
- 2.13 Teplota samovznícení
- 2.14 Povrchové napětí
- 2.15 Spalné teplo
- 2.16 Reaktivita
- 3 použití
- 3.1 Rozpouštědlo a reakční prostředí
- 3.2 Srážecí činidlo
- 3,3 oktanu
- 4 Odkazy
Struktura
n-heptan a jeho intermolekulární interakce
Jak je vidět na prvním obrázku, molekula n-Heptan je lineární a vzhledem k chemické hybridizaci jeho atomů uhlíku má řetězec tvar cikcaku. Tato molekula je dynamická, protože její vazby C-C se mohou otáčet, což způsobí, že se řetěz mírně ohne pod různými úhly. To přispívá k jejich intermolekulárním interakcím..
The n-heptan je nepolární, hydrofobní molekula, a proto jsou jeho interakce založeny na londýnských disperzních silách; Jedná se o ty, které závisí na molekulární hmotnosti sloučeniny a její kontaktní ploše. Dvě molekuly n-heptan se k sobě přibližují tak, že své řetězy „zaklínují“ jeden na druhém.
Tyto interakce jsou dostatečně účinné k udržení molekul n-Heptan soudržný v kapalině, která se vaří při 98 ° C.
Izomery
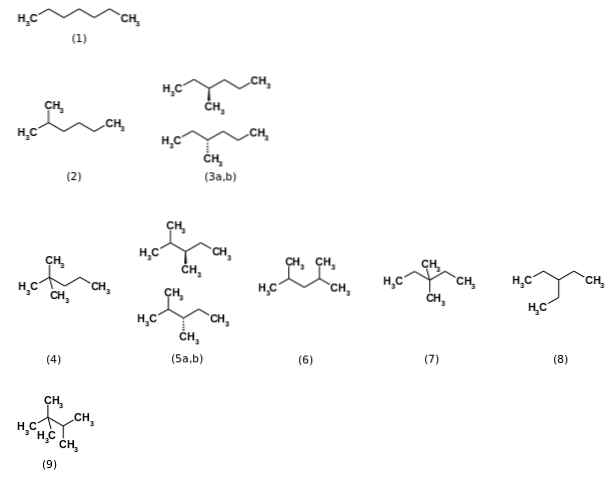
Nejprve bylo řečeno, že vzorec C7H16 představuje celkem devět strukturních izomerů, přičemž n-nejdůležitější heptan (1). Dalších osm izomerů je zobrazeno na obrázku výše. Na první pohled si všimněte, že některé jsou více rozvětvené než jiné. Zleva doprava, počínaje shora, máme:
(2): 2-methylhexan
(3): 3-methylhexan, který se skládá z dvojice enantiomerů (a a b)
(4): 2,2-dimethylpentan, také známý jako neoheptan
(5): 2,3-dimethylpentan, opět s párem enantiomerů
(6): 2,4-dimethylpentan
(7): 3,3-dimethylpentan
(8): 3-ethylpentan
(9): 2,2,3-trimethylbutan.
Každý z těchto izomerů má vlastnosti a aplikace nezávislé na n-heptan, vyhrazený hlavně pro oblasti organické syntézy.
Vlastnosti heptanu
Fyzický vzhled
Bezbarvá kapalina s benzínovým zápachem.
Molární hmotnost
100,205 g / mol
Bod tání
-90,549 ° C, stává se molekulárním krystalem.
Bod varu
98,38 ° C.
Tlak páry
52,60 atm při 20 ° C Všimněte si, jak vysoký je jeho tlak par, přestože je méně těkavý než jiná parafinická rozpouštědla, jako je hexan a pentan..
Hustota
0,6795 g / cm3. Na druhou stranu jsou výpary heptanu 3,45krát hustší než vzduch, což znamená, že jeho výpary budou setrvávat v prostorách, kde se vylije trochu jeho kapaliny..
Rozpustnost ve vodě
Heptan, který je hydrofobní sloučeninou, se stěží rozpouští ve vodě za vzniku roztoku o koncentraci 0,0003% při teplotě 20 ° C..
Rozpustnost v jiných rozpouštědlech
Heptan je mísitelný s tetrachlormethanem, ethanolem, acetonem, petroletherem a chloroformem..
Index lomu (nD)
1,3855.
Viskozita
0,389 mPa s
Tepelná kapacita
224,64 J / K mol
bod vznícení
-4 ° C
teplota samovznícení
223 ° C
Povrchové napětí
19,66 mN / m při 25 ° C
Spalné teplo
4817 kJ / mol.
Reaktivita
Heptanové páry, jsou-li v blízkosti zdroje tepla (plamene), reagují exotermicky a energicky s kyslíkem ve vzduchu:
C7H16 + 11Odva => 7COdva + 8HdvaNEBO
Avšak mimo spalovací reakci je heptan poměrně stabilní kapalinou. Jeho nedostatek reaktivity je způsoben skutečností, že jeho C-H vazby je obtížné rozbít, takže není náchylný k substitucím. Stejně tak není příliš citlivý na silná oxidační činidla, pokud poblíž není oheň..
Největším nebezpečím heptanu je jeho vysoká těkavost a hořlavost, takže při rozlití na horká místa existuje nebezpečí požáru.
Aplikace
Rozpouštědlo a reakční médium

Hydrofobní charakter heptanu z něj činí vynikající rozpouštědlo pro rozpouštění olejů a tuků. V tomto aspektu byl použit jako odmašťovač. Jeho největší aplikace však spočívá v tom, že se používá jako extrakční rozpouštědlo, protože rozpouští lipidové složky i další organické sloučeniny ve vzorku..
Pokud byste například chtěli extrahovat všechny složky mleté kávy, byla by namísto vody macerována v heptanu. Tato metoda a její varianty byly implementovány u všech druhů semen, díky čemuž byly získány rostlinné esence a další přírodní produkty..
Heptan, který je přirozeně bezbarvý, bude zabarvovat barvu extrahovaného oleje. Poté se otáčí, aby měl konečně co nejčistší objem oleje..
Na druhou stranu nízká reaktivita heptanu také umožňuje, aby byla alternativou při zvažování reakčního média k provedení syntézy. Jelikož je dobrým rozpouštědlem pro organické sloučeniny, zajišťuje, že činidla zůstanou v roztoku a při reakci správně reagují.
Srážecí činidlo
V ropné chemii je běžnou praxí vysrážet asfaltény ze surového vzorku přidáním heptanu. Tato metoda umožňuje studovat stabilitu různých surových olejů a určit, jak citlivý je jejich obsah asfaltenu na srážení a způsobení celé řady problémů ropnému průmyslu..
Oktan
Heptan byl používán jako palivo kvůli velkému množství tepla, které vydává při hoření. Pokud jde o motory automobilů, bylo by to na újmu jejich výkonu, pokud by byly použity v čisté formě. Protože hoří velmi výbušně, slouží k definování 0 na oktanové stupnici benzinu..
Benzín obsahuje vysoké procento heptanu a dalších uhlovodíků, aby se oktanové číslo dostalo na známé hodnoty (91, 95, 87, 89 atd.).
Reference
- Morrison, R. T. a Boyd, R, N. (1987). Organická chemie. 5. vydání. Redakční Addison-Wesley Interamericana.
- Carey F. (2008). Organická chemie. (Šesté vydání). Mc Graw Hill.
- Graham Solomons T.W., Craig B.Fryhle. (2011). Organická chemie. (10. vydání.). Wiley plus.
- Wikipedia. (2020). Heptan. Obnoveno z: en.wikipedia.org
- Národní centrum pro biotechnologické informace. (2020). Heptanová databáze PubChem. CID = 8900. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Elsevier B.V. (2020). Heptany ScienceDirect. Obnoveno z: sciencedirect.com
- Bell Chem Corp. (7. září 2018). Průmyslové využití heptanu. Obnoveno z: bellchem.com
- Andrea Kropp. (2020). Heptan: Struktura, použití a vzorec. Studie. Obnoveno z: study.com


Zatím žádné komentáře