
Vlastnosti hydrakridu, nomenklatura, použití a příklady

The hydracidy nebo binární kyseliny jsou sloučeniny rozpuštěné ve vodě, které jsou tvořeny vodíkem a nekovovým prvkem: halogenovodíky. Jeho obecný chemický vzorec lze vyjádřit jako HX, kde H je atom vodíku a X je nekovový prvek..
X může patřit do skupiny 17, halogenů nebo k prvkům skupiny 16 bez zahrnutí kyslíku. Na rozdíl od oxokyselin chybí hydracidům kyslík. Jelikož jsou hydrokraidy kovalentní nebo molekulární sloučeniny, je třeba vzít v úvahu vazbu H-X. To má velký význam a definuje vlastnosti každého hydracidu..
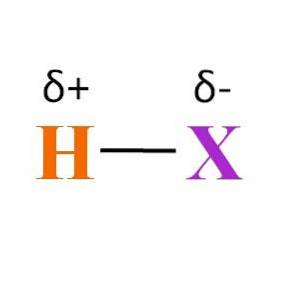
A co vazba H-X? Jak je vidět na obrázku výše, existuje stálý produkt dipólového momentu různých elektronegativit mezi H a X. Protože X je obvykle více elektronegativní než H, přitahuje svůj elektronický mrak a končí záporným částečným nábojem δ-.
Na druhou stranu, tím, že dáme část své elektronové hustoty X, skončí s kladným částečným nábojem δ +. Čím zápornější δ-, tím bohatší na elektrony X bude a tím větší bude nedostatek elektronů H. Proto, v závislosti na tom, který prvek X je, může být hydracid víceméně polární.
Obrázek také odhaluje strukturu hydracidů. H-X je lineární molekula, která může na jednom ze svých konců interagovat s jinou. Čím více je polární HX, tím silněji nebo s afinitou budou jeho molekuly interagovat. Ve výsledku se zvýší jeho teplota varu nebo tání.
Interakce H-X-H-X jsou však stále dostatečně slabé, aby vedly k pevné hydracidě. Z tohoto důvodu se za podmínek tlaku a teploty okolí jedná o plynné látky; S výjimkou HF, který se odpařuje nad 20 ° C.
Proč? Protože HF je schopen vytvářet silné vodíkové vazby. Zatímco ostatní hydracidy, jejichž nekovové prvky jsou méně elektronegativní, těžko mohou být v kapalné fázi pod 0 ° C. Například HCl se vaří při asi -85 ° C.
Jsou hydracidy kyselé látky? Odpověď spočívá v kladném parciálním náboji δ + na atomu vodíku. Pokud je δ + velmi velký nebo je vazba H-X velmi slabá, pak HX bude silná kyselina; jako u všech hydrokyselin halogenů, jakmile jsou jejich příslušné halogenidy rozpuštěny ve vodě.
Rejstřík článků
- 1 Funkce
- 1.1 Fyzické
- 1.2 Chemie
- 2 Názvosloví
- 2.1 Bezvodá forma
- 2.2 Ve vodném roztoku
- 3 Jak se tvoří?
- 3.1 Přímé rozpouštění halogenovodíku
- 3.2 Rozpouštění solí nekovů kyselinami
- 4 použití
- 4.1 Čisticí prostředky a rozpouštědla
- 4.2 Kyselé katalyzátory
- 4.3 Činidla pro syntézu organických a anorganických sloučenin
- 5 příkladů
- 5,1 HF, kyselina fluorovodíková
- 5,2 H2S, sirovodík
- 5,3 HCl, kyselina chlorovodíková
- 5,4 HBr, kyselina bromovodíková
- 5,5 H2Te, kyselina tellurová
- 6 Reference
Vlastnosti
Fyzický
-Je zřejmé, že všechny hydracidy jsou průhledná řešení, protože HX jsou velmi rozpustné ve vodě. Mohou mít nažloutlé tóny podle koncentrací rozpuštěného HX.
-Jsou to kuřáci, což znamená, že vydávají husté, žíravé a dráždivé dýmy (některé z nich jsou dokonce nevolné). Je to proto, že molekuly HX jsou velmi těkavé a interagují s vodní párou v prostředí obklopujícím roztoky. Kromě toho jsou HX ve svých bezvodých formách plynné sloučeniny..
-Hydracidy jsou dobrým vodičem elektřiny. Ačkoli HX jsou za atmosférických podmínek plynné druhy, po rozpuštění ve vodě uvolňují ionty (H+X-), které umožňují průchod elektrického proudu.
-Jeho teploty varu jsou vyšší než u jejích bezvodých forem. To znamená, že HX (ac), který označuje hydracid, se vaří při teplotách nad HX (g). Například chlorovodík, HCl (g), se vaří při -85 ° C, ale kyselina chlorovodíková, její hydracid, kolem 48 ° C..
Proč? Protože plynné molekuly HX jsou obklopeny molekulami vody. Mohou nastat dva typy interakcí současně: vodíkové vazby, HX - HdvaO - HX nebo iontová solvatace, H3NEBO+(ac) a X-(ac). Tato skutečnost přímo souvisí s chemickými vlastnostmi hydracidů..
Chemikálie
Hydracidy jsou velmi kyselé roztoky, takže mají kyselé protony H3NEBO+ k dispozici pro reakci s jinými látkami. Kde je H3NEBO+? Z atomu vodíku s kladným částečným nábojem δ +, který se disociuje ve vodě a nakonec je kovalentně inkorporován do molekuly vody:
HX (aq) + HdvaO (l) <=> X-(ac) + H3NEBO+(ac)
Všimněte si, že rovnice odpovídá reakci, která nastoluje rovnováhu. Když vznik X-(ac) + H3NEBO+(ac) je termodynamicky velmi oblíbený, HX uvolní svůj kyselý proton do vody; a pak tento, s H3NEBO+ jako nový „nosič“ může reagovat s jinou sloučeninou, i když druhá není silná báze.
Výše uvedené vysvětluje kyselé vlastnosti hydracidů. To je případ všech HX rozpuštěných ve vodě; ale některé generují kyselější roztoky než jiné. Co to je? Důvody mohou být velmi komplikované. Ne všechny HX (ac) upřednostňují přední rovnováhu směrem doprava, to znamená směrem k X-(ac) + H3NEBO+(ac).
Kyselost
A výjimka je pozorována u kyseliny fluorovodíkové, HF (aq). Fluor je velmi elektronegativní, proto zkracuje vzdálenost vazby H-X a posiluje ji proti jejímu rozpadu působením vody..
Podobně vazba H-F má mnohem lepší překrytí z důvodů poloměru atomu. Na druhou stranu jsou vazby H-Cl, H-Br nebo H-I slabší a mají sklon k úplné disociaci ve vodě, až do rozbití výše uvedené rovnováhy..
Je to proto, že ostatní halogeny nebo chalkogeny (například síra) mají větší atomové poloměry, a proto větší orbitaly. V důsledku toho vazba H-X vykazuje horší orbitální překrytí, protože X je větší, což zase ovlivňuje sílu kyseliny při kontaktu s vodou..
Tímto způsobem je sestupné pořadí kyselosti pro hydrokyseliny halogenů následující: HF< HCl Jak jsou pojmenovány hydracidy? Ve svých bezvodých formách, HX (g), je třeba je zmínit jako diktované pro halogenovodíky: přidání přípony -ide na konec jejich jmen. Například HI (g) se skládá z halogenidu (nebo hydridu) tvořeného vodíkem a jodem, proto se jmenuje: jodzubr vodík. Protože nekovy jsou obecně více elektronegativní než vodík, má oxidační číslo +1. Naproti tomu v NaH má vodík oxidační číslo -1. Toto je další nepřímý způsob diferenciace molekulárních hydridů od halogenů nebo halogenovodíků od jiných sloučenin.. Jakmile HX (g) přijde do styku s vodou, je to reprezentováno jako HX (ac) a pak máme hydracid. Chcete-li pojmenovat hydracid, HX (ac), musí být přípona -ide jejích bezvodých forem nahrazena příponou -hydric. A měly by být na prvním místě zmíněny jako kyseliny. Pro výše uvedený příklad je tedy HI (ac) pojmenován jako: jod kyselinyhydr. Hydracidy lze vytvořit jednoduchým rozpuštěním jejich odpovídajících halogenovodíků ve vodě. To lze vyjádřit následující chemickou rovnicí: HX (g) => HX (střídavý proud) HX (g) je velmi rozpustný ve vodě, takže neexistuje rovnováha rozpustnosti, na rozdíl od jeho iontové disociace k uvolnění kyselých protonů. Existuje však syntetická metoda, která je upřednostňována, protože používá jako surovinu soli nebo minerály a rozpouští je při nízkých teplotách se silnými kyselinami.. Pokud se stolní sůl, NaCl, rozpustí s koncentrovanou kyselinou sírovou, dojde k následující reakci: NaCl (s) + HdvaSW4(aq) => HCl (aq) + NaHSO4(ac) Kyselina sírová daruje jeden ze svých kyselých protonů chloridovému aniontu Cl-, čímž se převede na kyselinu chlorovodíkovou. Z této směsi může unikat chlorovodík, HCl (g), protože je velmi těkavý, zvláště pokud je jeho koncentrace ve vodě velmi vysoká. Druhou vyrobenou solí je síran sodný, NaHSO4. Dalším způsobem, jak jej vyrobit, je nahradit kyselinu sírovou koncentrovanou kyselinou fosforečnou: NaCl (s) + H3PO4(aq) => HCl (aq) + NaHdvaPO4(ac) H3PO4 reaguje stejně jako HdvaSW4, produkující kyselinu chlorovodíkovou a fosforečnan sodný. NaCl je zdrojem aniontu Cl-, takže k syntéze ostatních hydrokaridů jsou zapotřebí soli nebo minerály obsahující F.-, Br-, Já-, Sdva-, atd. Ale použití HdvaSW4 nebo H3PO4 bude to záviset na jeho oxidační síle. HdvaSW4 Je to velmi silné oxidační činidlo do té míry, že oxiduje i Br- a já- do jejich molekulárních forem Brdva a jádva; první je načervenalá kapalina a druhá fialová pevná látka. Proto je H3PO4 představuje v takových syntézách preferovanou alternativu. Hydracidy se v podstatě používají k rozpouštění různých druhů látek. Je to proto, že jsou to silné kyseliny a mohou umírnit jakýkoli povrch.. Jeho kyselé protony se přidávají ke sloučeninám nečistot nebo nečistot, čímž jsou rozpustné ve vodném prostředí, a poté jsou taženy vodou. V závislosti na chemické povaze uvedeného povrchu může být použit jeden nebo druhý hydrracid. Například kyselinu fluorovodíkovou nelze použít k čištění skla, protože je na místě rozpustí. Kyselina chlorovodíková se používá k odstranění skvrn z dlaždic bazénů. Jsou také schopné rozpouštět horniny nebo pevné vzorky a poté se používají pro analytické nebo výrobní účely v malém nebo velkém měřítku. Při iontoměničové chromatografii se k čištění kolony od zbývajících iontů používá zředěná kyselina chlorovodíková.. Některé reakce vyžadují vysoce kyselé roztoky, aby se urychlily a zkrátily se jejich čas. To je místo, kde přicházejí hydracidy. Příkladem toho je použití kyseliny jodovodíkové při syntéze ledové kyseliny octové. Ropný průmysl také potřebuje hydrracidy v rafinérských procesech. Hydracidy poskytují nejen kyselé protony, ale také jejich příslušné anionty. Tyto anionty mohou reagovat s organickou nebo anorganickou sloučeninou za vzniku specifického halogenidu. Tímto způsobem je lze syntetizovat: fluoridy, chloridy, jodidy, bromidy, selenidy, sulfidy a další sloučeniny více. Tyto halogenidy mohou mít velmi různorodé aplikace. Mohou být například použity k syntéze polymerů, jako je teflon; nebo zprostředkovatelé, ze kterých budou atomy halogenu inkorporovány do molekulárních struktur určitých léčiv. Předpokládejme molekulu CH3CHdvaOH, ethanol, reaguje s HCl za vzniku ethylchloridu: CH3CHdvaOH + HCl => CH3CHdvaCl + HdvaNEBO Každá z těchto reakcí skrývá mechanismus a mnoho aspektů, které jsou zvažovány v organických syntézách.. Pro hydracidy není k dispozici mnoho příkladů, protože počet možných sloučenin je přirozeně omezený. Z tohoto důvodu jsou níže uvedeny některé další hydracidy s příslušnou nomenklaturou (zkratka (ac) je ignorována): Binární hydracid, jehož molekuly H-F tvoří silné vodíkové vazby, do té míry, že ve vodě je slabou kyselinou. Na rozdíl od do té doby uvažovaných hydracidů je polyatomický, to znamená, že má více než dva atomy, je však stále binární, protože jde o dva prvky: síru a vodík.. Jeho úhlové molekuly H-S-H netvoří znatelné vodíkové vazby a lze je detekovat podle jejich charakteristického zápachu po shnilém vejci.. Jedna z nejznámějších kyselin v populární kultuře. Je dokonce součástí složení žaludeční šťávy přítomné v žaludku a spolu s trávicími enzymy odbourávají potravu. Stejně jako kyselina jodovodíková se v plynné fázi skládá z lineárních molekul H-Br, které se disociují na ionty H.+ (H3NEBO+) a Br- když vstoupí do vody. Ačkoli má telur určitý kovový charakter, jeho hydracid vydává nepříjemné a vysoce jedovaté páry, jako je selenid vodíku.. Stejně jako ostatní hydracidy chalkogenidů (ze skupiny 16 periodické tabulky) produkuje v roztoku anion Tedva-, takže jeho valence je -2.Nomenklatura
Bezvodá forma
Ve vodném roztoku
Jak se tvoří?
Přímé rozpouštění halogenovodíku
Rozpouštění solí nekovů kyselinami
Aplikace
Čisticí prostředky a rozpouštědla
Kyselé katalyzátory
Činidla pro syntézu organických a anorganických sloučenin
Příklady
HF, kyselina fluorovodíková
HdvaS, sirovodík
HCl, kyselina chlorovodíková
HBr, kyselina bromovodíková
HdvaTe, kyselina tellurová
Reference



Zatím žádné komentáře