
Co je hydrolýza a příklady reakcí

The hydrolýza Jedná se o chemickou reakci, která může nastat v anorganických i organických molekulách nebo iontech, a která zahrnuje účast vody na rozbití jejich vazeb. Jeho název pochází z řečtiny, „hydro“ vody a „lýzy“ prasknutí.
Molekula vody, HdvaNebo nastoluje rovnováhu s ionty solí slabých kyselin a zásad, tento koncept se poprvé objevuje v obecných studiích chemie a v analytické chemii. Jedná se tedy o jednu z nejjednodušších chemických reakcí.
V několika příkladech hydrolýzy není voda sama schopná rozbít určitou kovalentní vazbu. Když k tomu dojde, proces je urychlen nebo katalyzován okyselením nebo alkalizací média; to znamená v přítomnosti iontů H3NEBO+ u OH-, resp. Podobně existují enzymy, které katalyzují hydrolýzu.
Pokud jde o biomolekuly, zaujímá hydrolýza zvláštní místo, protože vazby, které drží své monomery pohromadě, jsou za určitých podmínek náchylné k hydrolýze. Například cukry jsou hydrolyzovány, aby rozložily polysacharidy na své základní monosacharidy díky působení enzymů glukosidázy.
Rejstřík článků
- 1 Co je to hydrolýza?
- 2 Příklady hydrolýzních reakcí
- 2.1 - ATP
- 2.2 - Voda
- 2.3 - Proteiny
- 2.4 - Amidy a estery
- 2,5 - Kyselinová báze
- 3 Odkazy
Co je to hydrolýza?
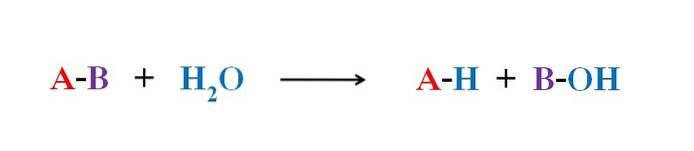
Obrázek výše vysvětluje, z čeho se skládá hydrolýza. Všimněte si, že nejen molekula nebo substrát (pokud zprostředkovávají enzymy) rozbije svou vazbu, ale také samotná voda, která se „zlomí“ na H+ a OH-, kde H+ končí A a OH- s B. A-B tedy reaguje s molekulou vody za vzniku dvou produktů, A-H a B-OH.
Hydrolýza je tedy opačnou reakcí než kondenzace. Při kondenzaci se dva produkty, řekněme A-H a B-OH, spojují uvolněním malé molekuly: voda. Při hydrolýze je molekula spotřebována, zatímco při kondenzaci se uvolňuje nebo produkuje.
Vrátíme-li se k příkladu cukrů, předpokládejme, že A-B odpovídá dimeru sacharózy, kde A představuje glukózu a B představuje fruktózu. Vazba A-B, glykosidová, může být hydrolyzována za vzniku dvou monosacharidů odděleně a v roztoku, a totéž se stane s oligo a polysacharidy, pokud při těchto reakcích zprostředkovávají enzymy..
Všimněte si, že v této reakci, A-B, má šipka pouze jeden směr; to znamená, že jde o nevratnou hydrolýzu. Mnoho hydrolýz je však ve skutečnosti reverzibilní reakcí, které dosahují rovnováhy.
Příklady hydrolýzních reakcí
- ATP
ATP je stabilní mezi hodnotami pH 6,8 a 7,4. Při extrémních hodnotách pH však spontánně hydrolyzuje. U živých bytostí je hydrolýza katalyzována enzymy známými jako ATPázy:
ATP + HdvaO => ADP + Pi
Tato reakce je silně exergonická, protože entropie ADP je větší než entropie ATP. Variace Gibbsovy volné energie (ΔGº) je - 30,5 kJ / mol. Energie vyrobená hydrolýzou ATP se používá v mnoha endergonických reakcích.
Spojené reakce
V některých případech se hydrolýza ATP používá k přeměně sloučeniny (A) na sloučeninu (B).
A + ATP + HdvaNEBO <=> B + ADP + Pi + H+
- Voda
Dvě molekuly vody mohou na sebe reagovat zjevnou hydrolýzou:
HdvaO + HdvaNEBO <=> H3NEBO+ + Ach-
Je to, jako by se jedna z těchto molekul vody rozpadla na H+ a OH-, propojím H+ na atom kyslíku druhé molekuly vody, což vede k hydroniovému iontu, H3NEBO+. Tato reakce, více než hydrolýza, je o autoionizaci nebo autoprotolýze vody.
- Protein
Proteiny jsou stabilní makromolekuly a pro dosažení jejich úplné hydrolýzy jsou v aminokyselinách, které je tvoří, nutné extrémní podmínky; jako je koncentrace kyseliny chlorovodíkové (6 M) a vysoké teploty.
Živé bytosti jsou však vybaveny enzymatickým arzenálem, který umožňuje hydrolýzu bílkovin na aminokyseliny v dvanáctníku. Enzymy podílející se na trávení bílkovin jsou téměř úplně vylučovány slinivkou břišní.
Existují exopeptidázové enzymy, které degradují proteiny, počínaje jejich konci: aminopeptidáza na aminovém konci a karboxypeptidáza na karboxylovém konci. Enzymy endopeptidázy působí uvnitř proteinového řetězce, například: trypsin, pepsin, chymotrypsin atd..
- Amidy a estery
Amidy po zahřátí v alkalickém prostředí způsobí vznik karboxylové kyseliny a aminu:
RCONHdva + HdvaO => RCOO- + NHdva
Estery ve vodném prostředí se hydrolyzují na karboxylovou kyselinu a alkohol. Proces je katalyzován buď zásadou nebo kyselinou:
RCO-OR '+ HdvaO => RCOOH + R'OH
Toto je slavná zmýdelňovací reakce.
- Kyselinová báze
Ve vodě se několik druhů hydrolyzuje, aby se okyselilo nebo zalkalizovalo vodné prostředí.
Přidání základní soli
Octan sodný, zásaditá sůl, se ve vodě disociuje za vzniku iontů Na+ (sodík) a CH3VRKAT- (acetát). Jeho bazicita je dána skutečností, že acetát je hydrolyzován za vzniku OH iontů-, zatímco sodík zůstává nezměněn:
CH3VRKAT- + HdvaNEBO <=> CH3COOH + OH-
OH- je zodpovědný za vzestup pH a jeho zásaditost.
Přidání kyselé soli
Chlorid amonný (NH4Cl) je tvořen chloridovým iontem (Cl-) z kyseliny chlorovodíkové (HCl), silné kyseliny a amonného kationtu (NH4+) z hydroxidu amonného (NH4OH), slabá báze. Cl- Nerozděluje se ve vodě, ale amonný kation se transformuje na vodu následovně:
NH4+ + HdvaNEBO <=> NH3 + H3NEBO+
Hydrolýza amonného kationu produkuje protony, které zvyšují kyselost vodného prostředí, takže se dospělo k závěru, že NH4Cl je kyselá sůl.
Přidání neutrální soli
Chlorid sodný (NaCl) je solný produkt reakce silné báze (NaOH) se silnou kyselinou (HCl). Rozpuštěním chloridu sodného ve vodě se sodný kation (Na+) a anion (Cl-). Oba ionty se nerozdělí ve vodě, takže nepřidávají H+ u OH-, udržování konstantní hodnoty pH.
Proto se říká, že chlorid sodný je neutrální sůl..
Reference
- Mathews, C. K., van Holde, K. E. a Ahern, K. G. (2002). Biochemie. (Třetí edice). Upravit. Pearson-Addison Wesley.
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Helmenstine, Anne Marie, Ph.D. (13. ledna 2019). Hydrolýza: Definice a příklady. Obnoveno z: thoughtco.com
- Theresa Phillips. (28. dubna 2019). Vysvětlení procesu hydrolýzy. Obnoveno z: thebalance.com
- Redaktoři Encyclopaedia Britannica. (2016, 16. listopadu). Hydrolýza. Encyklopedie Britannica. Obnoveno z: britannica.com
- Wikipedia. (2019). Hydrolýza. Obnoveno z: en.wikipedia.org



Zatím žádné komentáře