
Struktura hydroxidu niklu (III), vlastnosti, použití, rizika

The hydroxid nikelnatý Je to anorganická sloučenina, kde má kovový nikl oxidační číslo 3+. Jeho chemický vzorec je Ni (OH)3. Podle konzultovaných zdrojů dosud nebylo možné ověřit existenci hydroxidu nikelnatého Ni (OH)3, ale bylo možné získat oxo-hydroxid nikelnatý, NiO (OH).
Oxohydroxid nikelnatý NiO (OH) je černá krystalická pevná látka, která krystalizuje ve dvou formách: beta a gama. Nejběžnější krystalickou formou NiO (OH) je beta.
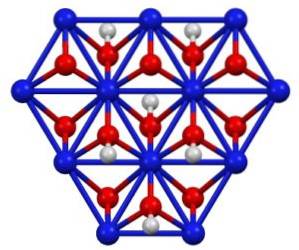
NiO (OH) lze získat oxidací roztoků dusičnanů niklu (II) (Ni (NO3)dva) s chlorem (Cldva) nebo brom (Brdva) v přítomnosti hydroxidu draselného (KOH). Oxohydroxid nikelnatý je velmi rozpustný v kyselinách. Má uplatnění v niklových bateriích, v superkondenzátorech a jako regenerovatelný katalyzátor.
Oxid hydroxidu nikelnatého NiO (OH) a hydroxidu nikelnatého Ni (OH)dva jsou sjednoceni v provozu většiny svých aplikací, protože obě jsou součástí stejné rovnice redukce oxidů.
Jako sloučenina niklu představuje NiO (OH) stejná rizika jako jiné soli niklu, tj. Podráždění kůže nebo dermatitida a rakovina..
Rejstřík článků
- 1 Krystalová struktura
- 2 Elektronická konfigurace
- 3 Názvosloví
- 4 Vlastnosti
- 4.1 Fyzický stav
- 4.2 Rozpustnost
- 4.3 Další vlastnosti
- 5 použití
- 5.1 V niklových bateriích
- 5.2 V elektrokatalýze jako regenerovatelný katalyzátor
- 5.3 V superkondenzátorech
- 5.4 Při oxidaci kovových iontů
- 6 Rizika
- 7 Reference
Krystalická struktura
Oxohydroxid nikelnatý krystalizuje ve dvou formách: beta a gama. Beta forma β-NiO (OH) má velmi podobnou strukturu jako β-Ni (OH)dva, což se zdá logické, protože první pochází z oxidace druhé.
Forma gama y-NiO (OH) je produkt oxidace hydroxidu niklu (II) v jeho alfa formě, α-Ni (OH)dva. Stejně jako druhá má gama vrstvenou strukturu s ionty alkalických kovů, anionty a vodou rozptýlenou mezi vrstvami..
Elektronická konfigurace
V NiO (OH) je nikl v oxidačním stavu 3+, což znamená, že v jeho vnějších vrstvách chybí 3 elektrony, to znamená, že ve vrstvě 4 chybí dva elektronys a elektron ze skořápky 3d. Elektronová konfigurace Ni3+ v NiO (OH) je to: [Ar] 3d7, kde [Ar] je elektronová konfigurace argonu vzácného plynu.
Nomenklatura
- NiO (OH): oxohydroxid nikelnatý
- Niklová černá
Vlastnosti
Fyzický stav
Černá krystalická pevná látka.
Rozpustnost
NiO (OH) oxohydroxid je velmi rozpustný v kyselinách. Gama fáze se rozpouští v kyselině sírové s vývojem kyslíku.
Další vlastnosti
V horké vodě se z ní stává nikl (II) a (III) oxohydroxid, Ni3NEBOdva(ACH)4.
Při 140 ° C se rozkládá na oxid nikelnatý (NiO), vodu a kyslík.
Gama fázi (γ-NiO (OH)) lze získat různými způsoby, například zpracováním niklu roztavenou směsí peroxidu sodného (NadvaNEBOdva) a hydroxid sodný (NaOH) při 600 ° C a ochlazení v ledové vodě.
Gama fáze se při zahřátí na 138 ° C rozkládá.
Aplikace
V niklových bateriích
Edisonova nikl-železná baterie, ve které se jako elektrolyt používá KOH, je založena na reakci oxohydroxidu nikelnatého se železem:
Stažení:
Fe + 2NiO (OH) + HdvaO ⇔ Fe (OH)dva + 2Ni (OH)dva
Zatížení:
Jedná se o reverzibilní oxidačně-redukční reakci.
Na anodě těchto baterií probíhá řada chemických a elektrochemických procesů. Zde je obecný přehled:
Stažení
β-Ni (OH)dva ⇔ β-NiO (OH) + H+ + a-
Zatížení
Stárnutí ↑ ↓ Přetížení
Stažení
α-Ni (OH)dva ⇔ γ-NiO (OH) + H+ + a-
Zatížení
V technologii niklových baterií se nikl (III) oxohydroxid NiO (OH) nazývá „aktivní hmota niklu“.

V elektrokatalýze jako regenerovatelný katalyzátor
NiO (OH) se úspěšně používá při elektrosyntéze azopyrazolů elektrokatalytickou oxidací aminopyrazolů. Rovněž byla prokázána jeho užitečnost při syntéze karboxylových kyselin z alkoholů nebo karbonylových sloučenin..

Dalším příkladem je kvantitativní přeměna hydroxymethylpyridinu na pyridinkarboxylovou kyselinu. V tomto případě je ocelová nebo niklová elektroda odpovídající anodě pokryta vrstvou NiO (OH). Médium, ve kterém se provádí elektrolýza, je zásadité.
Při těchto reakcích působí NiO (OH) jako mediátor redukční-oxidace nebo „redoxní“ mediátor..
Elektrolýza se provádí v článku s niklovou anodou a titanovou katodou v alkalickém prostředí. Během procesu se tvoří Ni (OH)dva na povrchu niklové anody, která se rychle oxiduje na NiO (OH):
Ni (OH)dva + Ach- - a- ⇔ NiO (OH) + HdvaNEBO
NiO (OH) reaguje s organickým substrátem a získává se požadovaný organický produkt regenerací Ni (OH)dva:
NiO (OH) + organická sloučenina → Ni (OH)dva + produkt
Jak se regeneruje Ni (OH)dva, katalýza pokračuje.
Použití NiO (OH) jako elektrokatalyzátoru umožňuje získat organické sloučeniny s nízkými náklady a ekologickým způsobem.
V superkondenzátorech
NiO (OH) společně s Ni (OH)dva vyrábět vynikající materiály pro superkondenzátorové elektrody. superkondenzátory).
Ni (OH)dva + Ach- ⇔ NiO (OH) + HdvaO + e-
Mají vysokou kapacitu, nízké náklady a podle některých referencí i nízký dopad na životní prostředí.

Mají však nízkou vodivost. To je řešeno použitím nanočástic uvedených sloučenin, protože to zvětšuje povrch a zmenšuje vzdálenost potřebnou pro difúzi, což zajišťuje vysokou rychlost přenosu elektronů a / nebo iontů..
Při oxidaci kovových iontů
Jedna z komerčních aplikací oxohydroxidu nikelnatého je založena na jeho schopnosti oxidovat ionty kobaltu v roztoku na ionty kobaltu..
Rizika
Nikl v roztoku je stabilnější jako Ni iontdva+, proto není obvyklé přijít do styku s roztoky Ni3+. Opatření jsou však stejná, protože nikl, ať už kovový, v roztoku nebo ve formě jeho pevných solí, může způsobit senzibilizaci kůže..
Doporučuje se používat ochranné prostředky a oděv, jako je obličejový štít, rukavice a bezpečnostní obuv. To vše musí být použito, kdykoli existuje možnost kontaktu s roztoky niklu..
Pokud se objeví dermatitida, měla by být ošetřena lékařem, aby se vyloučilo, že je způsobena niklem..
Pokud jde o možnost vdechování, je dobrým zvykem udržovat ve vzduchu velmi nízkou koncentraci prachu nikelnatých solí pomocí místního větrání a v případě potřeby používat ochranu dýchacích cest..
Všechny sloučeniny niklu jsou klasifikovány Mezinárodní agenturou pro výzkum rakoviny nebo IARC. Mezinárodní agentura pro výzkum rakoviny), v kategorii karcinogenů pro člověka.
Toto je založeno na epidemiologických a experimentálních datech.
Reference
- Cotton, F. Albert a Wilkinson, Geoffrey. (1980). Pokročilá anorganická chemie. Čtvrté vydání. John Wiley & Sons.
- Lyalin, B.V. et al. Elektrosyntéza azopyrazolů oxidací N-alkylaminopyrazolů na NiO (OH) anodě ve vodné zásadě - Zelená metoda pro N-N homocoupling. Čtyřstěn dopisy. 59 (2018) 2741-2744. Obnoveno ze sciencedirect.com.
- Liuyang, Zhang a kol. (2018). Materiály na bázi niklu pro superkondenzátory. Materiály dnes. Obnoveno ze sciencedirect.com
- Ettel, V.A. a Mosolu, M. A. (1977). Příprava niklové černé. NÁS. Patent č. 4 006 216. 1. února 1977.
- Scharbert, B. (1993). Způsob oxidace derivátů hydroxymethylpyridinu na deriváty pyridinkarboxylové kyseliny na anodách hydroxidu niklu. NÁS. Patent č. 5,259,933. 9. listopadu 1993.
- Kirk-Othmer (1994). Encyclopedia of Chemical Technology. Svazek 17. Čtvrté vydání. John Wiley & Sons.
- Ullmann's Encyclopedia of Industrial Chemistry. (1990). Páté vydání. Svazek A 17. VCH Verlagsgesellschaft mbH.
- McBreen, James. (1997). Hydroxidy niklu. V příručce k bateriovým materiálům. Vydavatel VCH. Obnoveno z osti.gov.



Zatím žádné komentáře