
Struktura hydroxidu sodného (NaOH), vlastnosti, použití, syntéza

The hydroxid sodný Je to anorganická sloučenina, jejíž chemický vzorec je NaOH a sestává z velmi silné kovové báze nebo zásady. Jeho 5% roztok ve vodě má pH blízké 14.
Je to velmi hygroskopická bílá pevná látka, která může také absorbovat oxid uhličitý ze vzduchu za vzniku uhličitanu sodného. Komerčně přichází v plastových lahvích jako pilulky, které nemohou být příliš dlouho vystaveny vzduchu, ani s nimi nesmí být manipulováno pomocí špachtle.

Hydroxid sodný lze syntetizovat reakcí hydroxidu vápenatého s uhličitanem sodným. V současné době je však zásadně syntetizován elektrolýzou solanky a je vedlejším produktem výroby plynného chloru.
Vzhledem k vysoké zásaditosti NaOH má mnoho použití a aplikací, jako je výroba papíru, mýdel, detergentů, barviv atd. Používá se také při čištění domácnosti, úpravě vody, zpracování hliníku, výrobě léčiv atd .; a především je to sekundární vzor par excellence.
Hydroxid sodný je velmi žíravý a může způsobit podráždění a popáleniny kůže a očí. Vdechováním prachu může způsobit plicní edém. Jeho požití může mezitím způsobit tak vážné poškození trávicího traktu, že může vést k smrti..
Rejstřík článků
- 1 Struktura
- 1.1 Bezvodý
- 1.2 Hydráty
- 2 Fyzikální a chemické vlastnosti
- 2.1 Jména
- 2.2 Molární hmotnost
- 2.3 Vzhled
- 2.4 Teplota tání
- 2.5 Bod varu
- 2.6 Rozpustnost ve vodě
- 2.7 Bazicita (pKb)
- 2,8 pH
- 2.9 Index lomu (nD)
- 2.10 Stabilita
- 2.11 Rozklad
- 2.12 Bod samovznícení
- 2.13 Viskozita
- 2.14 Odpařovací teplo
- 2.15 Povrchové napětí
- 2.16 Reaktivita
- 3 Syntéza
- 3.1 Reakce uhličitanu sodného a hydroxidu vápenatého
- 3.2 Elektrolýza chloridu sodného
- 4 použití
- 4.1 Čisticí prostředky
- 4.2 Farmaceutické a léčivé přípravky
- 4.3 Energetické procesy
- 4.4 Úprava vody
- 4.5 Výroba papíru
- 4.6 Průmyslová výroba
- 5 Rizika
- 6 Reference
Struktura
Bezvodý

Horní obrázek ukazuje ionty, které tvoří NaOH. Na kation+ je reprezentován fialovou sférou, zatímco hydroxylový anion (hydroxid nebo hydroxyl) OH- červenou a bílou koulí. Oba ionty Na+ a OH- interagují mezi sebou elektrostatickou přitažlivostí svých opačných nábojů.
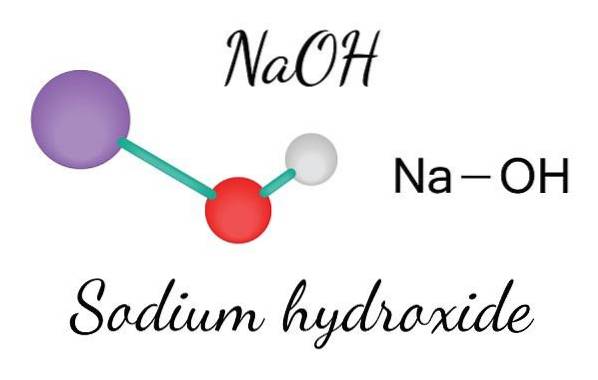
Takové interakce jsou nesměrové, takže přitažlivost iontového páru Na+Ach- na určitou vzdálenost to může ovlivnit ostatní. Výsledkem je, že ionty Na+ odpuzují se navzájem, stejně jako OH-, dokud nedefinují krystal minimální energie, kde vytvoří uspořádanou a periodickou strukturu (krystalickou).
Proto se objevují ortorombické krystaly bezvodého NaOH (bez vody):
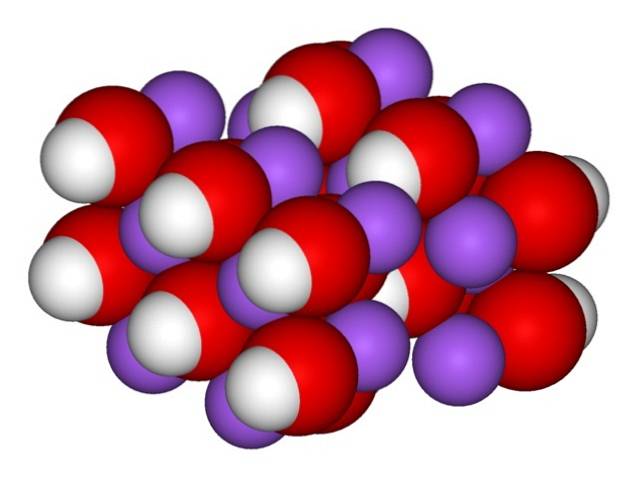
Ionty zůstávají dostatečně soudržné, takže bezvodý krystal NaOH taje při 323 ° C (pokud není v prostředí vlhkost).
Hydráty
Jak Na+ jako OH- Jsou to ionty, které molekuly vody snadno solvatují (hydratují). To upřednostňuje jeho hydrataci nad retikulární energií jejích krystalů, a proto NaOH uvolňuje při kontaktu s vodou spoustu energie..
Bezvodé krystaly však mohou hostovat nerozpuštěné molekuly vody; to znamená, že hydroxid sodný může tvořit četné hydráty, NaOH nHdvaO. Molekula vody může dobře tvořit vodíkovou vazbu s OH- (HOH-OH-), nebo koordinovat s Na+ (Na+-Achdva).
V závislosti na molárním poměru mezi NaOH a HdvaNebo monohydráty (NaOHHdvaO), dihydráty (NaOH 2HdvaO), trihemidráty (NaOH 3,5HdvaO), tetrahydráty (NaOH 4HdvaO), heptahydráty (NaOH 7HdvaO) a další.
Každý z těchto hydrátů může krystalizovat z vodného roztoku NaOH s různými hmotnostními procenty a při různých teplotách. V důsledku toho vykazuje NaOH komplikovaný diagram rozpustnosti ve vodě..
Obecně jsou krystaly hydrátů méně husté a mají nižší teploty tání. Je to proto, že molekuly vody „brání“ interakcím mezi Na+ a OH-, přidání dipól-dipólových sil při obětování iontových atrakcí.
Fyzikální a chemické vlastnosti
Jména
Preferovaný název IUPAC: hydroxid sodný. Jiná jména: Louh sodný, Ascarite (méně časté)
Molární hmotnost
39,9971 g / mol
Vzhled
Bílá, serózní nebo neprůhledná pevná látka nebo krystaly.
Bod tání
323 ° C
Bod varu
1 388 ° C
Rozpustnost ve vodě
1 000 g / l při teplotě 25 ° C To ukazuje, kolik se může rozpustit ve vodě..
Jejich vodné roztoky jsou viskózní, s viskozitou asi osmdesátkrát vyšší než voda, a zpočátku uvolňují hodně tepla. Pokud s nimi přijdete do styku, způsobí to, že pokožka bude kluzká kvůli zmýdelnění mastných kyselin v kůži..
Bazicita (pKb)
- 0,56
pH
5% hmotn./hmotn. Roztok ve vodě má pH blízké 14
Index lomu (nD)
Při vlnové délce 580,4 nm: 1 433 při 320 ° C a 1 421 při 420 ° C.
Stabilita
Nádoby, které ho obsahují, musí být hermeticky uzavřeny, aby se zabránilo tvorbě uhličitanu sodného. Důvodem je jeho vysoká hygroskopičnost, která ho vede k absorpci vlhkosti z okolí a obsahu CO.dva.
Rozklad
Při zahřátí na rozklad vydává kouř oxidu sodného.
Bod samovznícení
Není hořlavý
Viskozita
4,0 cPoise při 350 ° C
Odpařovací teplo
175 kJ / mol při 1388 ° C
Povrchové napětí
74,35 dynu / cm ve 2,72% hmotn./hmotn. Roztoku ve vodě při 18 ° C.
Reaktivita
S kyselinami
Reaguje s organickými a anorganickými minerálními kyselinami za vzniku vody a odpovídající soli. V případě kyseliny sírové je reakce exotermická.
2 NaOH + HdvaSW4 => NadvaSW4 + 2 hdvaNEBO
S oxidy kyselin
Reaguje například s oxidem siřičitým za vzniku siřičitanové soli a vody:
2 NaOH + SOdva => NadvaSW3 + HdvaNEBO
S kovy
Jeho vodné roztoky reagují s některými kovy za vzniku komplexních sodných solí. Například jeho reakce se zinkem vede k zinočnanu sodnému:
Zn + 2 NaOH + 2 HdvaO => Nadva[Zn (OH)4] + Hdva
Syntéza
Hydroxid sodný se syntetizuje hlavně dvěma způsoby: použitím původně použitého uhličitanu sodného a elektrolýzou chloridu sodného, který je v současné době ve větším průmyslovém použití..
Reakce uhličitanu sodného a hydroxidu vápenatého
Uhličitan sodný reaguje s hydroxidem vápenatým v procesu známém jako kaustifikace:
Ca (OH)dva + NadvaCO3 => CaCO3 + NaOH
Uhličitan vápenatý se vysráží a v supernatantu zůstane hydroxid sodný, který se zahustí odpařením.
Uhličitan sodný pochází dříve z procesu Solvay:
2 NaCl + CaCO3 => NadvaCO3 + CaCldva
Elektrolýza chloridu sodného
Elektrolýza chloridu sodného přítomného v solném roztoku produkuje plynný vodík, plynný chlorid a hydroxid sodný ve vodném roztoku:
2 Nacl + 2 HdvaO => Hdva + Cldva + 2 NaOH
Elektrolytická komora se skládá z komory, kde je anoda (+), vyrobená z titanového kovu, a místa, kde je umístěna solanka. Tato komora je oddělena od katodové komory (-) porézní membránou..
Na anodě dochází k následující reakci:
2 Cl- => Cldva + 2 e- (oxidace)
Mezitím k této reakci dochází na katodě:
2 hdvaO + 2 e- => Hdva + Ach- (snížení)
Sodík (Na+) difunduje z anodového oddělení do katodového oddělení přes membránu, která je odděluje, za vzniku hydroxidu sodného.
Aplikace
Čistící prostředky
Hydroxid sodný se používá k výrobě mýdel a detergentů používaných v domácnosti a v podnikání. Kombinace hydroxidu sodného a chloru vytváří chlórové bělidlo, které se používá při praní bílých oděvů.
Rovněž eliminuje hromadění tuku v kanálech a produkuje jeho eliminaci přeměnou na mýdla procesem saponifikace. To umožňuje odstranění ucpání potrubí domů a dalších budov.
Farmaceutické a léčivé přípravky
Hydroxid sodný se používá k výrobě běžných léků proti bolesti, jako je aspirin. Také léky s antikoagulačním účinkem, které blokují tvorbu krevních sraženin, a léky ke snížení hypercholesterolemie.
Energetické procesy
Hydroxid sodný se používá při výrobě palivových článků, které fungují jako baterie, a vyrábějí elektřinu pro různé aplikace, včetně dopravy. Epoxidové pryskyřice vyráběné za pomoci hydroxidu sodného se používají ve větrných turbínách.
Úprava vody
Hydroxid sodný se používá k neutralizaci kyselosti vody a přispívá k odstraňování těžkých kovů z ní. Používá se také k výrobě chlornanu sodného, dezinfekčního prostředku na vodu.
Hydroxid sodný reaguje se síranem hlinitým za vzniku hydroxidu hlinitého: flokulační činidlo, které se používá v zařízeních na úpravu vody ke zvýšení sedimentace částic a zajišťuje jejich čiření..
Výroba papíru
Hydroxid sodný se používá se sulfidem sodným při zpracování dřeva k získání celulózy v téměř čisté formě, která tvoří základ papíru. Používá se také při recyklaci papíru, protože tím, že pomáhá oddělit inkoust, umožňuje jeho opětovné použití.
Průmyslová výroba
Hydroxid sodný se používá při výrobě hedvábí, spandexu, výbušnin, epoxidových pryskyřic, skla a keramiky. Používá se v textilním průmyslu k výrobě barviv a zpracování bavlněných tkanin.
V čistírnách cukrové třtiny se nízkotepelný hydroxid sodný používá k výrobě ethanolu z bagasy z cukrové třtiny.
Rizika
Hydroxid sodný je vysoce korozivní sloučenina, takže při kontaktu s pokožkou může způsobit popáleniny, puchýře a dokonce i trvalé jizvy.
Při kontaktu s očima může způsobit těžké popáleniny, otoky, bolest, rozmazané vidění a v závažných případech může způsobit trvalou slepotu..
Polykání hydroxidu sodného může způsobit popáleniny rtů, jazyka, hrdla, jícnu a žaludku. Mezi běžné příznaky patří nevolnost, zvracení, křeče v žaludku a průjem..
Ačkoli je vdechování hydroxidu sodného vzácné a může nastat pouze v důsledku přítomnosti prachu ve vzduchu ve vzduchu nebo v důsledku tvorby mlhy, která ho obsahuje, vyvolává podráždění v plicích..
V případě chronické expozice to může způsobit plicní edém a těžkou dušnost, což představuje lékařskou pohotovost..
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Wikipedia. (2019). Hydroxid sodný. Obnoveno z: en.wikipedia.org
- Národní centrum pro biotechnologické informace. (2019). Hydroxid sodný. Databáze PubChem. CID = 14798. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Americké prvky. (2019). Roztok hydroxidu sodného. Obnoveno z: americanelements.com
- Fakta o chemické bezpečnosti. (2019). Hydroxid sodný. Obnoveno z: chemicalafetyfacts.org
- NJ zdraví. (2015). Hydroxid sodný. [PDF]. Obnoveno z: nj.gov
- Kanadské centrum pro bezpečnost a ochranu zdraví při práci. (2019). Informační listy o bezpečnosti a ochraně zdraví při práci: hydroxid sodný. Obnoveno z: ccohs.ca
- Ausetute. (s.f.). Výroba hydroxidu sodného a chloru elektrolýzou. Obnoveno z: ausetute.com.au



Zatím žádné komentáře