
Inkretinové typy a jejich struktura, funkce, mechanismus účinku
The inkretin jsou gastrointestinální hormony, které stimulují sekreci fyziologických koncentrací inzulínu. Termín se v současné době používá k označení dvou různých střevních hormonů, které mají různé technické názvy: GIP nebo „glukózo-závislý inzulinotropní polypeptid“ a GLP-1 nebo „glukagonový peptid 1“.
„Inkretin“ je slovo a pojem vytvořený v roce 1932 belgickým fyziologem Jean La Barre, který jej zavedl k definování intestinálních hormonálních faktorů, které doplňovaly účinky sekretinu na sekreci endokrinního pankreatu..
Jinými slovy, La Barre používal termín inkretin k označení jakéhokoli střevního hormonu, který za fyziologických podmínek byl schopen stimulovat nebo přispívat k sekreci pankreatických hormonů, jako je inzulín, glukagon, pankreatický polypeptid (PP) a somatostatin..
V současné době se však termín „inkretin“ používá pouze k označení těch hormonů, které jsou schopné stimulovat syntézu pankreatického inzulínu závislého na glukóze, konkrétně dvou peptidů známých jako GIP a GLP-1. Příchod nových technologií a hlubších endokrinologických studií by však mohl odhalit mnoho dalších peptidů s podobnými aktivitami..
Rejstřík článků
- 1 Druhy inkretinů a jejich struktura
- 2 funkce
- 3 Mechanismus účinku
- 3.1 GIP: Glukóza-dependentní inzulinotropní polypeptid
- 3,2 GLP-1: peptid podobný glukagonu 1
- 4 Odkazy
Druhy inkretinů a jejich struktura
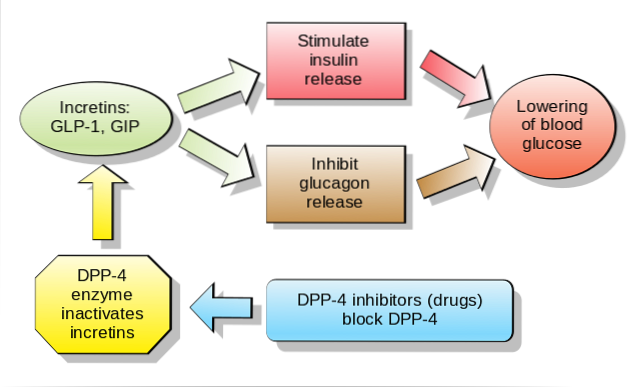
Tradičně byly u lidí definovány pouze dva inkretiny: glukózo-dependentní inzulinotropní polypeptid (GIP) a glukagonový peptid 1 (GLP-1); dva hormony aditivně působí při stimulaci sekrece inzulínu.
První z nich, který se izoloval, byl glukózo-dependentní inzulinotropní polypeptid (GIP). Insulinotropní polypeptid závislý na glukóze). Je to peptidový hormon s přibližně 42 aminokyselinami a patří do rodiny peptidů glukagon-sekretin.

Druhým objeveným inkretinem byl peptid podobný glukagonu 1 (GLP-1). Peptid podobný glukagonu), což je vedlejší produkt genu, který kóduje hormon „proglukagon“; část C-terminálního konce proteinu, abych byl přesnější.
Funkce
Zpočátku byly inkretiny definovány jako faktory pocházející ze střevního traktu, které mají schopnost snižovat hladinu glukózy v plazmě stimulací sekrece pankreatických hormonů, jako je inzulín a glukagon..
Tento koncept byl zachován s příchodem radioimunotestů, kde byla potvrzena trvalá komunikace mezi střevem a endokrinním pankreasem..
Ukázalo se, že perorální podávání glukózy je spojeno s významným zvýšením plazmatických hladin inzulínu, zejména ve srovnání s výsledky získanými při intravenózním podání glukózy..
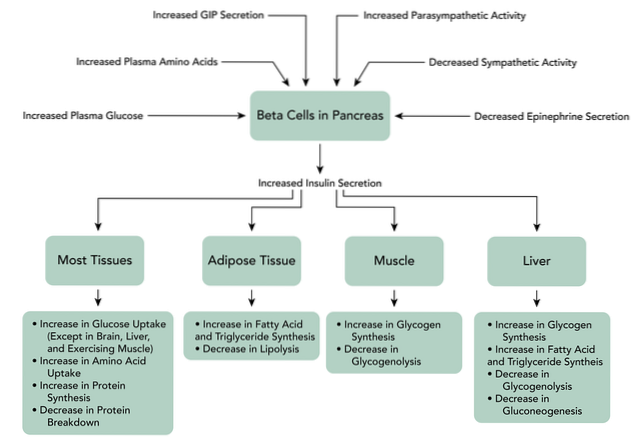
Předpokládá se, že inkretiny jsou odpovědné za sekreci téměř 70% plazmatického inzulínu po perorálním podání glukózy, protože jsou to hormony vylučované v reakci na příjem živin, což zvyšuje sekreci glukózy a inzulínu..
V současné době je vyvíjeno mnoho úsilí ohledně perorálního nebo intravenózního podávání inkretinu pacientům s onemocněním, jako je diabetes mellitus typu 2 nebo orální intolerance glukózy. Je to proto, že studie ukázaly, i když předběžně, že tyto látky usnadňují rychlý pokles glykemických hladin po příjmu potravy..
Mechanismus účinku
GIP: Glukóza-dependentní inzulinotropní polypeptid
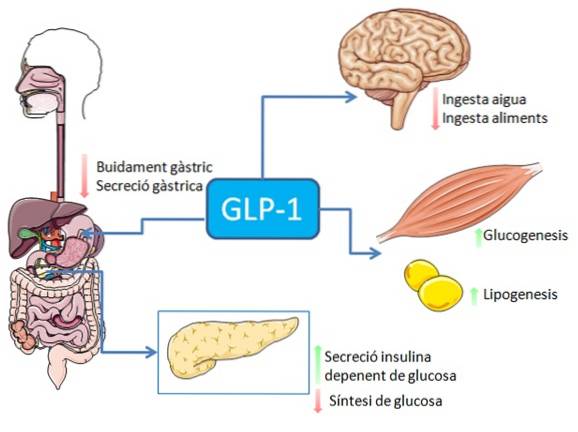
Tento inkretin je produkován K buňkami tenkého střeva (konkrétně v duodenu a jejunu) v reakci na požití tuku nebo glukózy a je zodpovědný za zvýšení sekrece inzulínu stimulované glukózou..
Exprese genu kódujícího tento hormonální faktor byla prokázána u lidí a hlodavců jak v žaludku, tak ve střevech. Studie prováděné s tímto hormonem naznačují, že je odvozen od 153 aminokyselinového prekurzoru „proGIP“, který má dva signální peptidy na svých N- a C-koncových koncích, které jsou štěpeny za vzniku aktivního peptidu o 42 zbytcích..
Poločas GIP je méně než 7 minut, jakmile je syntetizován a enzymaticky zpracován. Tento peptid je rozpoznáván specifickým receptorem, GIPR, který se nachází v plazmatické membráně buněk pankreatu, v žaludku, v tenkém střevě, v tukové tkáni, v kůře nadledvin, v hypofýze, v srdce, plíce a další hlavní orgány.
Když se GIP váže na své receptory na beta buňkách slinivky břišní, spouští zvýšení produkce cAMP, také inhibici draslíkových kanálů závislých na ATP, zvýšení intracelulárního vápníku a nakonec exocytózu granulí pro skladování inzulínu.
Kromě toho může tento peptid stimulovat transkripci genů a biosyntézu inzulínu, stejně jako další složky pankreatických beta buněk k "sčítání" glukózy. Ačkoli GIP funguje hlavně jako inkretinový hormon, vykonává také další funkce v jiných tkáních, jako je centrální nervový systém, kosti, mimo jiné..
GLP-1: peptid podobný glukagonu 1
Tento peptid je produkován z genu, který kóduje „proglukagon“, takže se jedná o peptid, který má téměř 50% identitu se sekvencí glukagonu, a proto se nazývá peptid podobný „glukagonu“.
GLP-1, posttranslační proteolytický produkt, je tkáňově specifický a je produkován L buňkami střeva v reakci na příjem potravy. Stejně jako GIP má i tento inkretin schopnost zvýšit sekreci inzulínu stimulovanou glukózou.
Genová exprese a zpracování
Tento peptid je kódován v jednom z exonů proglukagonového genu, který je exprimován v alfa buňkách pankreatu, v L buňkách střeva (v distálním ileu) a v neuronech mozkového kmene a hypotalamu.
V pankreatu je exprese tohoto genu stimulována nalačno a hypoglykemií (nízké koncentrace glukózy v krvi) a je inhibována inzulinem. Ve střevních buňkách je exprese genu pro proglukagon aktivována zvýšenou hladinou cAMP a příjmem potravy.
Produkt, který je výsledkem exprese tohoto genu, je posttranslačně zpracován v enteroendokrinních L buňkách (v tenkém střevě), což má za následek nejen uvolnění glukagonového peptidu 1, ale také další poněkud neznámé faktory, jako je glicentin, oxyintomodulin, peptid podobný glukagonu 2 atd..
Produkce a akce
Požití potravin, zejména těch, které jsou bohaté na tuky a uhlohydráty, stimuluje sekreci peptidu GLP-1 ze střevních enteroendokrinních L buněk (může také dojít k nervové stimulaci nebo stimulaci zprostředkované mnoha dalšími faktory)..
U lidí a hlodavců se tento peptid uvolňuje do krevního řečiště ve dvou fázích: 10-15 minut po požití a 30-60 minut později. Aktivní život tohoto hormonu v krvi je méně než 2 minuty, protože je rychle proteolyticky inaktivován enzymem dipeptidyl peptidáza-4 (DPP-4).
GLP-1 se váže na specifický membránový receptor (GLP-1R) na různých buňkách v těle, včetně některých endokrinních buněk pankreatu, kde stimuluje sekreci inzulínu závislou na glukóze.
Jak?
Vazba GLP-1 na jeho receptor na beta buňkách slinivky břišní aktivuje produkci cAMP zprostředkovanou adenylátcyklázou v těchto buňkách. Existuje přímá inhibice ATP-závislých draslíkových kanálů, které depolarizují buněčnou membránu.
Následně se zvyšuje hladina intracelulárního vápníku, což je výsledkem přílivu extracelulárního vápníku závislého na GLP-1 přes napěťově závislé kanály vápníku, aktivace neselektivních kationtových kanálů a mobilizace rezerv vápníku..
Také zvyšuje mitochondriální syntézu ATP, která podporuje depolarizaci. Později se napěťově řízené draselné kanály uzavřou, což zabrání repolarizaci beta buněk a nakonec dojde k exocytóze granulí pro skladování inzulínu..
V gastrointestinálním systému má vazba GLP-1 na jeho receptory inhibiční účinek na sekreci žaludeční kyseliny a vyprazdňování žaludku, což tlumí zvýšení hladiny glukózy v krvi spojené s příjmem potravy..
Reference
- Baggio, L. L. a Drucker, D. J. (2007). Biologie inkretinů: GLP-1 a GIP. Gastroenterology, 132 (6), 2131-2157.
- Deacon, C. F. a Ahrén, B. (2011). Fyziologie inkretinů ve zdraví a nemoci. Přehled diabetických studií: RDS, 8 (3), 293.
- Grossman, S. (2009). Diferenciace inkretinových terapií na základě aktivity struktury a metabolismu: zaměření na liraglutid. Farmakoterapie: The Journal of Human Pharmacology and Drug Therapy, 29 (12P2), 25S-32S.
- Kim, W., a Egan, J. M. (2008). Úloha inkretinů v homeostáze glukózy a léčbě cukrovky. Farmakologické přehledy, 60 (4), 470-512.
- Nauck, M. A., & Meier, J. J. (2018). Inkretinové hormony: jejich role ve zdraví a nemoci. Diabetes, obezita a metabolismus, 20, 5-21.
- Rehfeld, J. F. (2018). Původ a chápání inkretinové koncepce. Frontiers in endocrinology, 9.
- Vilsbøll, T., & Holst, J. J. (2004). Inkretiny, sekrece inzulínu a diabetes mellitus 2. typu. Diabetologia, 47 (3), 357-366



Zatím žádné komentáře