
Zákon aplikací hromadné akce, příklady
The zákon hromadné akce stanoví vztah mezi aktivními hmotami reaktantů a hmotami produktů za rovnovážných podmínek a v homogenních systémech (roztoky nebo plynné fáze). Byl formulován norskými vědci C.M. Guldberg a P. Waage, kteří uznali, že rovnováha je dynamická a není statická.
Proč dynamický? Protože rychlosti dopředné a zpětné reakce jsou stejné. Aktivní hmoty jsou obvykle vyjádřeny v mol / l (molarita). Takovou reakci lze napsat takto: aA + bB <=> cC + dD. Pro rovnováhu uvedenou v tomto příkladu je vztah mezi reaktanty a produkty znázorněn v rovnici na obrázku níže.
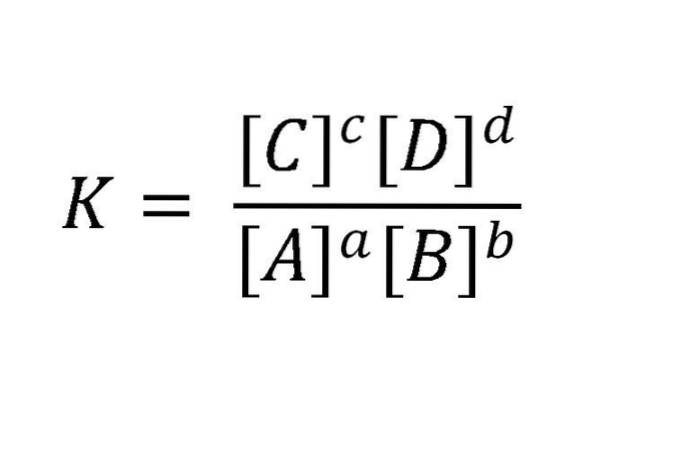
K je vždy konstantní bez ohledu na počáteční koncentrace látek, pokud se teplota nemění. Zde jsou A, B, C a D reaktanty a produkty; zatímco a, b, c a d jsou jejich stechiometrické koeficienty.
Numerická hodnota K je charakteristická konstanta pro každou reakci při dané teplotě. Potom K je to, co se nazývá rovnovážná konstanta.
Zápis [] znamená, že v matematickém vyjádření se koncentrace objevují v jednotkách mol / L, zvýšených na výkon rovný reakčnímu koeficientu.
Rejstřík článků
- 1 Co je zákon hromadné akce?
- 1.1 Význam rovnovážné konstanty
- 2 Chemická rovnováha
- 2.1 Rovnováha v heterogenních systémech
- 2.2 Rovnovážné posuny
- 3 Le Chatelierův princip
- 4 Aplikace
- 5 Příklady zákona o hromadné akci
- 6 Zákon hromadné akce ve farmakologii
- 7 Omezení
- 8 Reference
Jaký je zákon hromadné akce?
Jak již bylo zmíněno dříve, zákon hromadného působení vyjadřuje, že rychlost dané reakce je přímo úměrná součinu koncentrací reaktantů, přičemž koncentrace každého druhu je zvýšena na sílu rovnou jeho stechiometrickému koeficientu v chemické látce rovnice.
V tomto smyslu to lze lépe vysvětlit reverzibilní reakcí, jejíž obecná rovnice je ilustrována níže:
aA + bB ↔ cC + dD
Kde A a B představují reaktanty a látky pojmenované C a D představují produkty reakce. Podobně hodnoty a, b, c a d představují stechiometrické koeficienty A, B, C a D..
Počínaje předchozí rovnicí se získá výše uvedená rovnovážná konstanta, která je ilustrována jako:
K = [C]C[D]d/[NA]na[B]b
Když se rovnovážná konstanta K rovná kvocientu, ve kterém je čitatel tvořen násobením koncentrací produktů (v rovnovážném stavu) zvýšených na jejich koeficient ve vyvážené rovnici a jmenovatel se skládá z podobného násobení, ale mezi reaktanty se zvýšily na koeficient, který je doprovází.
Význam rovnovážné konstanty
Je třeba poznamenat, že v rovnici pro výpočet rovnovážné konstanty musí být použity koncentrace druhů v rovnováze, pokud nedojde k žádným změnám těchto hodnot nebo teploty systému..
Stejným způsobem poskytuje hodnota rovnovážné konstanty informace o směru, který je upřednostňován při reakci v rovnováze, tj. Odhaluje, zda je reakce příznivá vůči reaktantům nebo produktům..
Pokud je velikost této konstanty mnohem větší než jednota (K "1), rovnováha se posune doprava a zvýhodní produkty; zatímco pokud je velikost této konstanty mnohem menší než jednota (K" 1), rovnováha bude být nakloněn doleva a zvýhodní reaktanty.
I když podle konvence je naznačeno, že látky na levé straně šipky jsou reaktanty a látky na pravé straně jsou produkty, skutečnost, že reaktanty, které pocházejí z reakce v přímém smyslu, se stávají produkty v reakci v opačném směru a naopak.
Chemická rovnováha
Reakce často dosahují rovnováhy mezi množstvím výchozích látek a množstvím vzniklých produktů. Tato rovnováha se může dodatečně posunout ve prospěch zvýšení nebo snížení jedné z látek, které se účastní reakce..
Analogický fakt nastává při disociaci rozpuštěné látky: během reakce lze experimentálně s proměnlivou rychlostí pozorovat úbytek počátečních látek a tvorbu produktů.
Rychlost reakce je vysoce závislá na teplotě a v různé míře na koncentraci reaktantů. Ve skutečnosti jsou tyto faktory studovány zejména chemickou kinetikou.
Tato rovnováha však není statická, ale pochází z koexistence přímé a inverzní reakce..
V přímé reakci (->) se tvoří produkty, zatímco v inverzní reakci (<-) estos vuelven a originar las sustancias iniciales.
Výše uvedené představuje takzvanou dynamickou rovnováhu uvedenou výše..
Rovnováha v heterogenních systémech
V heterogenních systémech - to je, v těch, které jsou tvořeny několika fázemi - lze koncentrace pevných látek považovat za konstantní, s vynecháním matematického výrazu pro K.
Zloděj3(s) <=> CaO (y) + COdva(G)
V rovnováze rozkladu uhličitanu vápenatého lze tedy jeho koncentraci a koncentraci výsledného oxidu považovat za konstantní bez ohledu na jeho hmotnost..
Bilanční směny
Numerická hodnota rovnovážné konstanty určuje, zda reakce upřednostňuje tvorbu produktů. Když K je větší než 1, rovnovážný systém bude mít vyšší koncentraci produktů než reaktantů, a pokud K je menší než 1, nastane opak: v rovnováze bude větší koncentrace reaktantů než produktů..
Princip Le Chatelier
Vliv změn v koncentraci, teplotě a tlaku může změnit rychlost reakce.
Například pokud v reakci vznikají plynné produkty, zvýšení tlaku v systému způsobí, že reakce proběhne v opačném směru (směrem k reaktantům).
Obecně jsou anorganické reakce, které probíhají mezi ionty, velmi rychlé, zatímco organické mají mnohem nižší rychlosti..
Pokud se při reakci vytvoří teplo, má zvýšení venkovní teploty tendenci ji orientovat v opačném směru, protože reverzní reakce je endotermická (absorbuje teplo).
Podobně, pokud je v rovnováze způsoben přebytek jedné z reagujících látek v systému, ostatní látky vytvoří produkty, které uvedenou modifikaci co nejvíce neutralizují..
Výsledkem je, že se rovnováha posune zvýhodněním v jednom nebo druhém směru zvýšením reakční rychlosti takovým způsobem, že hodnota K zůstane konstantní..
Všechny tyto vnější vlivy a rovnovážná reakce proti nim působí tzv. Le Chatelierův princip..
Aplikace
Navzdory své nesmírné užitečnosti, když byl tento zákon navržen, neměl ve vědecké komunitě požadovaný účinek ani význam.
Od dvacátého století si však získal proslulost díky tomu, že se ho britští vědci William Esson a Vernon Harcourt znovu ujali několik desetiletí po jeho vyhlášení..
Zákon hromadné akce měl v průběhu času mnoho aplikací, z nichž některé jsou uvedeny níže:
- Protože je formulován spíše z hlediska aktivit než koncentrací, je užitečné určit odchylky od ideálního chování reaktantů v roztoku, pokud je to v souladu s termodynamikou..
- Jak se reakce blíží rovnováze, lze předpovědět vztah mezi čistou rychlostí reakce a okamžitou Gibbsovou volnou energií reakce..
- V kombinaci s podrobným principem rovnováhy tento zákon obecně poskytuje výsledné hodnoty, podle termodynamiky, aktivit a konstanty v rovnovážném stavu, jakož i vztah mezi nimi a výslednými rychlostními konstantami reakcí vpřed a zpětné směry.
- Když jsou reakce elementárního typu, použitím tohoto zákona získáme příslušnou rovnovážnou rovnici pro určitou chemickou reakci a vyjádření její rychlosti.
Příklady zákona o hromadné akci
-Při studiu nevratné reakce mezi ionty nalezenými v roztoku vede obecné vyjádření tohoto zákona k formulaci Brönsted-Bjerrum, která stanoví vztah mezi iontovou silou druhu a rychlostní konstantou.
-Při analýze reakcí prováděných ve zředěných ideálních roztocích nebo ve stavu plynné agregace se získá obecné vyjádření původního zákona (dekáda 80. let).
-Protože má univerzální vlastnosti, lze obecné vyjádření tohoto zákona použít jako součást kinetiky místo toho, aby se na něj pohlíželo jako na součást termodynamiky.
-Při použití v elektronice se tento zákon používá k určení, že násobení mezi hustotami otvorů a elektrony daného povrchu má konstantní velikost ve stavu rovnováhy, a to i nezávisle na dopingu dodávaném do materiálu..
-Použití tohoto zákona k popisu dynamiky mezi predátory a kořistí je široce známé za předpokladu, že vztah predace na kořisti představuje určitý poměr se vztahem mezi predátory a kořistí..
-V oblasti zdravotnických studií lze tento zákon dokonce použít k popisu určitých faktorů lidského chování z politického a sociálního hlediska.
Zákon hromadné akce ve farmakologii
Za předpokladu, že D je léčivo a R receptor, na který působí, reagují oba za vzniku komplexu DR, který je zodpovědný za farmakologický účinek:
K = [DR] / [D] [R]
K je disociační konstanta. Existuje přímá reakce, při které lék působí na receptor, a další, kde komplex DR disociuje na původní sloučeniny. Každá reakce má svou vlastní rychlost, vyrovná se pouze v rovnováze a uspokojí K..
Interpretace hmotnostního zákona do písmene, čím vyšší je koncentrace D, tím vyšší je koncentrace komplexu DR..
Celkové přijímače Rt však mají fyzický limit, takže pro všechny dostupné D neexistuje žádné neomezené množství R. Podobně experimentální studie v oblasti farmakologie zjistily následující omezení masového zákona v této oblasti:
- Předpokládá, že vazba R-D je reverzibilní, když ve většině případů opravdu není..
- Vazba R-D může strukturálně změnit kteroukoli ze dvou složek (léčivo nebo receptor), což je okolnost, která nezohledňuje hmotnostní zákon.
- Kromě toho masový zákon bledne tváří v tvář reakcím, kdy více zprostředkovatelů zasahuje do tvorby RD..
Omezení
Zákon hromadného působení předpokládá, že každá chemická reakce je elementárního typu; jinými slovy, že molekulárnost je stejná jako příslušné pořadí reakce pro každý zúčastněný druh.
Zde jsou stechiometrické koeficienty a, b, c a d považovány za počet molekul zapojených do reakčního mechanismu. V globální reakci se však nemusí nutně shodovat s jejich řádem..
Například pro reakci aA + bB <=> cC + dD:
Rychlost vyjádření pro přímé a inverzní reakce jsou:
k1= [A]na[B]b
kdva= [C]C[D]d
To platí pouze pro elementární reakce, protože u globálních jsou stechiometrické koeficienty správné, ale ne vždy jsou to reakční řády. V případě přímé reakce to může být:
k1= [A]w[B]z
V tomto výrazu by w a z byly skutečné reakční řády pro druhy A a B..
Reference
- Jeffrey Aronson. (2015, 19. listopadu). Zákony života: Guldberg a Waageův zákon hromadné akce. Citováno dne 10. května 2018 z webu: cebm.net
- ScienceHQ. (2018). Zákon hromadné akce. Citováno dne 10. května 2018 z: sciencehq.com
- askiitáni. (2018). Zákon hromadné akce a rovnovážná konstanta. Citováno dne 10. května 2018 z: askiitians.com
- Salvat Encyclopedia of Sciences. (1968). Chemie. Svazek 9, Salvat S.A. vydání Pamplona, Španělsko. P 13-16.
- Walter J. Moore. (1963). Fyzikální chemie. v Termodynamika a chemická rovnováha. (Čtvrté vydání). Longmans. P 169.
- Alex Yartsev. (2018). Zákon hromadné akce ve farmakodynamice. Citováno dne 10. května 2018 z: derangedphysiology.com



Zatím žádné komentáře