
Vlastnosti, struktura, typy a funkce myosinu
The myosin je to molekulární motor, proteinové povahy, schopný pohybu na aktinových vláknech v cytosolu. Energie, která řídí vytěsňování myosinu, pochází z hydrolýzy ATP. Z tohoto důvodu je myosin často definován jako mechanochemický enzym.
U eukaryot je myosin velmi bohatým proteinem. Existují různé třídy myosinu, které jsou kódovány rodinou genů. U kvasinek se rozlišuje 5 tříd, u savců byly popsány desítky.
Myosin má širokou škálu funkcí. Myosin I se spolu s aktinem podílí na pohybu keratocytů.
Myosin II zajišťuje tuhost plazmatické membrány, účastní se cytokineze a svalové kontrakce. Myosiny I i II spolupracují na migraci buněk. Myosiny I a V provádějí transport vezikul podél aktinových vláken.
Rejstřík článků
- 1 Struktura
- 2 Funkce
- 3 funkce
- 3.1 Svalová kontrakce
- 3.2 Cytokineze
- 3.3 Vyztužení kortikálních membrán
- 3.4 Adheze buněk
- 3.5 Vymístění některých vezikul
- 4 Nemoci související s myosinem
- 4.1 Myosiny a ztráta sluchu
- 4.2 Myosin X a rakovina
- 5 Reference
Struktura
Na elektronových mikrofotografiích má typická struktura izoforem myosinu tři domény: hlavu, krk a ocas. Hydrolýzou chymotrypsinem se získá segment skládající se z hlavy a krku, nazývaný těžký meromyosin (HMM), a segment ocasu, nazývaný lehký meromyosin (LMM).
Hlavním doménou je N-koncový konec těžkého řetězce a koncovou doménou je C-koncový konec lehkého řetězce.
Třídy myosinu lze odlišit počtem polypeptidových řetězců, které jej tvoří, a množstvím a třídou lehkého řetězce připojeného ke krku..
Myosin I má polypeptidový řetězec, který tvoří hlavu a jeho ocas postrádá alfa-šroubovité oblasti. Zatímco myosiny I a V mají dva polypeptidové řetězce, a proto tvoří dvě hlavy a ocas, ve kterých se spirálovité alfa řetězce stočily a vytvořily tyčovou strukturu.
Myosiny I a V mají vazebná místa pro kalmodulin, který reguluje a váže Ca+dva, na lehkých řetězech. Myosin I opravuje Ca+dva v lehkých řetězcích, ale dělá to jinak než kalmodulin.
Vlastnosti
Na mechanochemické úrovni mají myosiny tři charakteristiky, a to:
- Hlava myosinu je motorická doména, která postupuje v jednotlivých krocích: Spojení hlavy myosinu s aktinovým vláknem, jeho sklon a následná separace způsobují pohyb myosinu. Tento proces je cyklický a závisí na ATP.
- Konformní změny: hydrolýza molekuly ATP je spojena s každým krokem molekuly myosinu prostřednictvím úrovní amplifikace a přenosu. To zahrnuje velké konformační změny myosinu..
První úroveň amplifikace je způsobena ztrátou gama-fosfátové skupiny ATP, což umožňuje reorganizaci strukturních prvků v ATP-vazebném místě. Tato reorganizace je koordinována se strukturálními změnami v místě vázajícím aktin..
Druhá úroveň zesílení zahrnuje komunikaci konformační změny v aktivním místě se strukturálními složkami karboxylového terminálu..
- Směrovost: Bylo zjištěno, že myosiny mají polaritu nebo obrácenou směrovost k (+) konci aktinového vlákna. Tento závěr pochází z experimentů skluzu aktinových vláken za použití fluorescenčního světelného mikroskopu..
Funkce
Myosin se spolu s aktinem podílí mimo jiné na svalové kontrakci, adhezi buněk, cytokinezi, ztuhnutí kortikálních membrán a vytěsňování některých vezikul..
Poruchy myosinu mohou způsobit patologické stavy. Například defekty myosinů I a V souvisejí s myosinovými myopatiemi a poruchami pigmentace (Griscelliho syndrom). Zatímco poruchy v izoformách myosinu VI způsobují ztrátu sluchu.
Svalová kontrakce
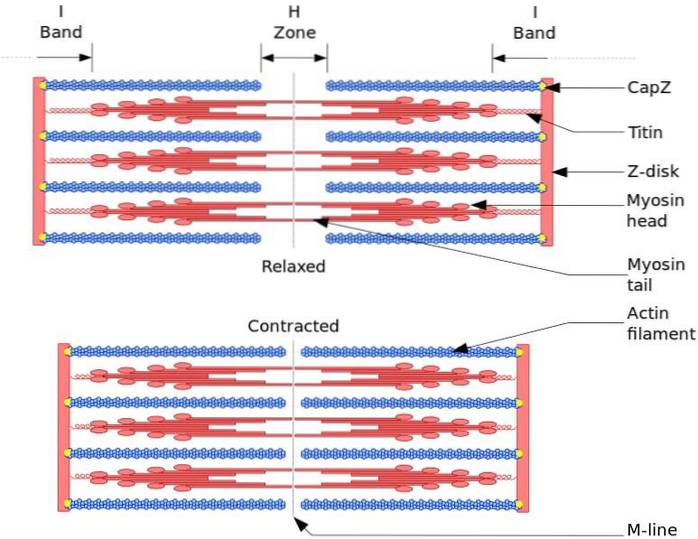
Funkční a strukturální jednotkou kosterního svalu je sarkoméra. Během svalové kontrakce dosahuje délka sarkomery 30% původní délky.
Sarcomeres jsou tvořeny silnými myosinovými vlákny a tenkými aktinovými vlákny, které jsou organizovány komplexním způsobem. Hlavy myosinů jsou obecně umístěny na distálních koncích vlákna a jejich ocasy směrem ke středu sarkomery a organizace je bipolární.
Aby došlo ke svalové kontrakci, musí se hlavy myosinu na opačných koncích pohybovat směrem k Z disku nebo (+) konci vlákna. Protože organizace tlustých vláken je bipolární, dochází ke klouzání tenkých vláken na tlustá vlákna, poháněné ATP.
K posunovací síle dochází proto, že stovky hlav myosinu, tlustého vlákna, interagují s tenkým vláknem.
Cytokineze
Během mitózy, kdy se mikrotubuly na pólech vřetena oddělují, tvoří aktin a myosin II kontraktilní prstenec na rovníku buňky. Tento prsten se smršťuje, zmenšuje jeho průměr a rozděluje buňku na dvě části..
Ztužení kortikálních membrán
V mutantních buňkách bez myosinu II se plazmatická membrána snadno deformuje působením vnější síly. To se děje proto, že myosin II poskytuje agregační sílu proteinům plazmatické membrány..
Adheze buněk
V epiteliální tkáni jsou kontraktilní svazky aktinu a myosinu II umístěny v blízkosti plazmatické membrány a tvoří kruhový pás, který obklopuje vnitřní povrch buňky. Tento kruhový pás určuje tvar buňky a udržuje vazbu mezi buňkami..
Ke kontaktu mezi buňkami dochází spojením kruhového pásu s molekulami buněčné adheze pomocí spojovacích proteinů.
Výtlak některých vezikul
Experimentální důkazy ukazují, že myosin V provádí membránový transport z Golgiho aparátu na periferii buňky. Některé důkazy jsou:
- V buňkách nervové tkáně bylo pomocí imunofluorescence astrocytů zjištěno, že myosin V se nachází vedle Golgiho.
- V kvasinkách mutace v genu pro myosin V narušují sekreci proteinu a následně se protein hromadí v cytosolu.
- Izoformy myosinu I jsou odpovědné za transport vakuol směrem k buněčné membráně. Použitím specifických protilátek proti izoformám myosinu I bylo zjištěno, že tyto izoformy jsou lokalizovány v různých částech buňky..
Například když je živá améba značena protilátkou proti myosinu IC, je zastaven transport vakuoly na membránu. Díky tomu se vakuola rozpíná a buňka praskne.
Onemocnění související s myosiny
Myosiny a ztráta sluchu
Existuje mnoho genů a mutací, které způsobují ztrátu sluchu. Toto onemocnění je často monogenetické .
Nekonvenční mutace myosinu s jednou nebo dvěma hlavami myosinu ovlivňují fungování vnitřního ucha. Některé z mutovaných izoforem myosinu jsou myosin IIIA, myosin VIIA a myosin XVA. Nedávno byly v myosinu VI objeveny dvě mutace.
Mutace v myosinu VI jsou c.897G> T a p.926Q. První mutace ovlivňuje oblast, která interaguje s aktivním místem, tzv. Přepínač I. Homozygotní pro mutaci vykazuje fenotyp brzy, což má závažné účinky.
Druhá mutace ovlivňuje oblast nabitých zbytků v alfa šroubovici na konci myosinu VI. Tato oblast je důležitá pro dimerizaci proximálního motoru a ovlivňuje stereociliární funkci myosinu VI..
Další mutací je p.Asn207Ser, který produkuje motor neschopný vytvářet sílu. Je to proto, že Asn 207 je aminokyselinový zbytek aktivního místa, jehož funkcí je vazba a hydrolýza ATP.
Mutace p.Arg657Trp způsobuje ztrátu funkce myosinu VI. Zbytek Arg se podílí na konformačních změnách, které spojují hydrolýzu s pohybem myosinu.
Myosin X a rakovina
Myosin X (Myo10) je nekonvenční myosin, který je exprimován v mozku, endotelu a mnoha epitelích. Myo10 a tři třídy projekcí založených na aktinu (filopodie, invadopody a projekce podobné filopodiím) fungují během metastáz rakoviny.
Invazivní rakovinné buňky mají velké množství filopodií a exprimují vysokou hladinu fasciny. Tento protein vytváří zesíťování mezi aktinovými vlákny. Za účelem úniku z primárního nádoru se tvoří invadopodie bohaté na proteolytickou aktivitu, které tráví okolní extracelulární matrix..
Jakmile buňky dosáhnou extracelulární matrice, projekce podobné filopodiím pomáhají rozptýlit se a kolonizovat. Vysoká hladina Myo10 naznačuje vysokou agresivitu a metastázy u rakoviny prsu.
Umlčení MyoX způsobuje ztrátu metastatického charakteru buněk, které nejsou schopné vytvářet projekce založené na aktinu. Všechny tyto projekce mají adheze na bázi integrinu, které jsou přenášeny pomocí Myo10 ve filopodiu..
MyoX se podílí na tvorbě centrosomu. Absence MyoX upřednostňuje tvorbu multipolárních vřeten. MyoX se také podílí na signalizaci v rakovinných buňkách. Například MyoX je aktivován 3,4,5, -inositol trifosfátem (PIP3).
Reference
- Alberts, B., Johnson, A., Lewis, J. a kol. 2007. Molekulární biologie buňky. Garland Science, New York.
- Brownstein, Z., Abu-Rayyan, A., Karfunkel-Doron, D., Sirigu, S., Davido, B., Shohat, M., Frydman, M., Houdusse, A., Kanaan, M., Avraham , K. 2014. Nové mutace myosinu pro dědičnou ztrátu sluchu odhalené cíleným genomovým zachycením a masivně paralelním sekvenováním. European Journal of Human Genetics, 22: 768-775.
- Courson, D.S. a Cheney, R.E. 2015. Myosin-X a nemoc. Experimental Cell Research, 334: 10-15.
- Lodish, H., Berk, A., Zipurski, S.L., Matsudaria, P., Baltimore, D., Darnell, J. 2003. Buněčná a molekulární biologie. Redakční Medica Panamericana, Buenos Aires, Bogotá, Caracas, Madrid, Mexiko, Sāo Paulo.
- Schliwa, M. a Woehlke, G. 2003. Molekulární motory. Nature, 422: 759-765.
- Dobře, R.D. 2003. Sada molekulárních motorů pro intracelulární transport. Cell, 112: 467-480.


Zatím žádné komentáře