
Charakteristické nepolární molekuly, identifikace a příklady
The nepolární molekuly jsou ty, které ve své struktuře představují symetrické rozložení svých elektronů. To je možné, pokud je rozdíl elektronegativity jejich atomů malý, nebo pokud elektronegativní atomy nebo skupiny vektorově zruší jejich účinky na molekulu..
Ne vždy je „apolarita“ absolutní. Z tohoto důvodu jsou molekuly s nízkou polaritou někdy považovány za nepolární; to znamená, že má dipólový moment µ blízký 0. Zde vstupujeme do pole relativního: jak nízké musí být µ, aby mohla být molekula nebo sloučenina považována za nepolární??
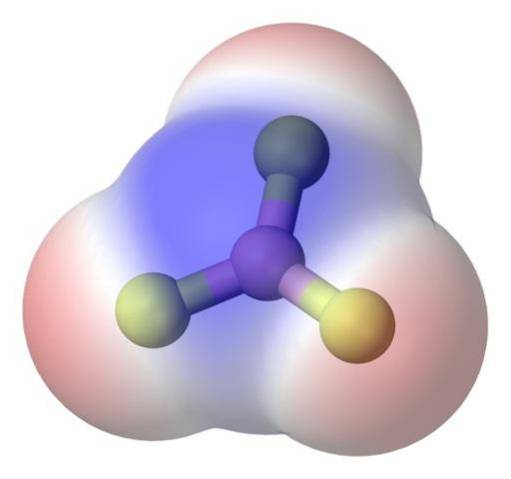
Pro lepší řešení problému existuje molekula fluoridu boritého BF3 (horní obrázek).
Atom fluoru je mnohem elektronegativní než atom boru, a proto jsou vazby B-F polární. Molekula BF3 je symetrický (trigonální rovina) a zahrnuje vektorové zrušení tří momentů B-F.
Tudíž jsou generovány také nepolární molekuly, a to i při existenci polárních vazeb. Vygenerovanou polaritu lze vyvážit existencí dalšího polárního spoje, stejné velikosti jako předchozí, ale orientovaného v opačném směru; jak se to děje v BF3.
Rejstřík článků
- 1 Vlastnosti nepolární molekuly
- 1.1 Symetrie
- 1.2 Elektronegativita
- 1.3 Mezimolekulární síly
- 2 Jak je identifikovat?
- 3 příklady
- 3.1 Vzácné plyny
- 3.2 Diatomické molekuly
- 3.3 Uhlovodíky
- 3.4 Ostatní
- 4 Odkazy
Vlastnosti nepolární molekuly
Symetrie
Aby se účinky polárních vazeb navzájem rušily, musí mít molekula určitou geometrickou strukturu; např. lineární, na první pohled nejsnadněji pochopitelné.
To je případ oxidu uhličitého (COdva), který má dvě polární vazby (O = C = O). Je to proto, že dva dipólové momenty vazeb C = O se ruší, když je jeden orientován na jednu stranu a druhý na druhou v úhlu 180 °..
Proto jednou z prvních charakteristik, které je třeba vzít v úvahu při hodnocení „apolarity“ molekuly z ptačí perspektivy, je pozorovat, jak je symetrická..
Předpokládejme, že místo COdva máme molekulu COS (O = C = S), nazývanou karbonylsulfid.
Nyní již nejde o nepolární molekulu, protože elektronegativita síry je menší než elektronegativita kyslíku; a proto je dipólový moment C = S odlišný od momentu C = O. Ve výsledku je COS polární molekula (jak polární je jiná záležitost).
Obrázek níže graficky shrnuje vše, co bylo právě popsáno:
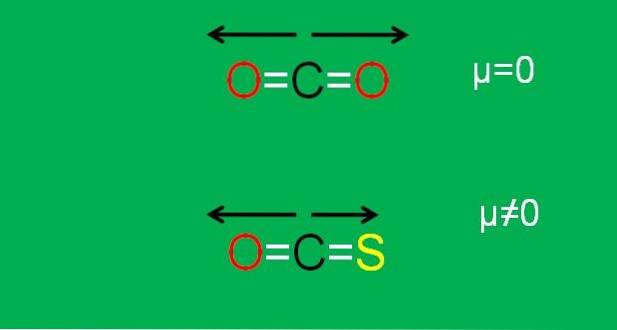
Všimněte si, že dipólový moment vazby C = S je menší než moment vazby C = O v molekule COS.
Elektronegativita
Elektronegativita na Paulingově stupnici má hodnoty mezi 0,65 (pro francium) a 4,0 (pro fluor). Obecně platí, že halogeny mají vysokou elektronegativitu.
Když je rozdíl v elektronegativitě prvků, které tvoří kovalentní vazbu, menší nebo rovný 0,4, říká se, že je nepolární nebo nepolární. Jedinými skutečně nepolárními molekulami jsou však ty, které jsou tvořeny vazbami mezi identickými atomy (jako je vodík, H-H)..
Mezimolekulární síly
Aby se látka mohla rozpustit ve vodě, musí elektrostaticky interagovat s molekulami; interakce, které apolární molekuly nemohou provádět.
V nepolárních molekulách se jejich elektrické náboje neomezují na jeden konec molekuly, ale jsou symetricky (nebo homogenně) distribuovány. Proto není schopen interakce pomocí dipól-dipólových sil.
Místo toho mezi sebou apolární molekuly interagují prostřednictvím rozptylových sil Londýna; Jedná se o okamžité dipóly, které polarizují elektronický mrak atomů sousedních molekul. Zde je molekulová hmotnost převládajícím faktorem ve fyzikálních vlastnostech těchto molekul..
Jak je identifikovat?
-Snad jednou z nejlepších metod k identifikaci nepolární molekuly je její rozpustnost v různých polárních rozpouštědlech, která je v nich obecně špatně rozpustná..
-Obecně mají nepolární molekuly plynnou povahu. Mohou také tvořit nemísitelné kapaliny s vodou.
-Nepolární pevné látky se vyznačují tím, že jsou měkké.
-Disperzní síly, které je drží pohromadě, jsou obecně slabé. Z tohoto důvodu mají jejich teploty tání nebo teploty varu nižší hodnoty než teploty sloučenin polární povahy..
-Nepolární molekuly, zejména v kapalné formě, jsou špatnými vodiči elektřiny, protože jim chybí čistý elektrický náboj..
Příklady
vzácné plyny
I když to nejsou molekuly, vzácné plyny jsou považovány za nepolární. Pokud se předpokládá, že dva z jeho atomů, He-He, interagují po krátkou dobu, lze tuto interakci považovat (napůl) za molekulu; molekula, která by měla nepolární povahu.
Diatomické molekuly
Diatomické molekuly, jako je Hdva, BRdva, jádva, Cldva, O.dva, a Fdva, jsou nepolární. Ty mají obecný vzorec Adva, A-A.
Uhlovodíky
Co kdyby A byla skupina atomů? Bylo by to před jinými nepolárními sloučeninami; například ethan, CH3-CH3, jehož uhlíková kostra je lineární, C-C.
Metan, CH4, a ethan, C.dvaH6, jsou to nepolární molekuly. Uhlík má elektronegativitu 2,55; zatímco elektronegativita vodíku je 2,2. Proto existuje dipólový vektor s nízkou intenzitou, orientovaný od vodíku k uhlíku..
Ale vzhledem k geometrické symetrii molekul metanu a etanu je součet dipólových vektorů nebo dipólových momentů v jejich molekulách nulový, takže na molekulách není žádný čistý náboj..
Obecně se totéž děje se všemi uhlovodíky, ai když jsou v nich nenasyceny (dvojné a trojné vazby), jsou považovány za nepolární sloučeniny nebo sloučeniny s nízkou polaritou. Cyklické uhlovodíky jsou také nepolární molekuly, jako je cyklohexan nebo cyklobutan.
Ostatní
Molekuly oxidu uhličitého (COdva) a sirouhlík (CSdva) jsou nepolární molekuly, obě s lineární geometrií.
V sirouhlíku je elektronegativita uhlíku 2,55, zatímco elektronegativita síry je 2,58; takže oba prvky mají prakticky stejnou elektronegativitu. Neexistuje žádná generace dipólového vektoru, a proto je čistý náboj nulový.
Podobně máme následující molekuly CCl4 a AlBr3, oba nepolární:
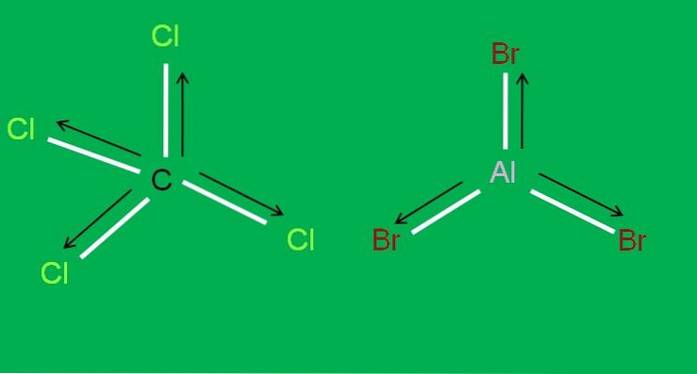
V bromidu hlinitém, AlBr3 totéž se děje s BF3, na začátku článku. Mezitím pro chlorid uhličitý CCl4, geometrie je čtyřboká a symetrická, protože všechny vazby C-Cl jsou stejné.
Podobně molekuly obecného vzorce CX4 (CF4, CI4 a CBr4), jsou také nepolární.
A konečně může apolární molekula mít dokonce oktaedrickou geometrii, jako je tomu v případě hexafluoridu síry, SF6. Ve skutečnosti může mít jakoukoli geometrii nebo strukturu, pokud je symetrická a její elektronická distribuce je homogenní..
Reference
- Carey F. A. (2008). Organická chemie. Karboxylové kyseliny. (Šesté vydání). Mc Graw Hill.
- Cedrón J., Landa V., Robles J. (2011). Molekulární polarita. Obnoveno z: corinto.pucp.edu.pe
- Pohled lektora. (2018). Nepolární molekula. Obnoveno z: chemistry.tutorvista.com
- Helmenstine, Anne Marie, Ph.D. (28. ledna 2019). Příklady polárních a nepolárních molekul. Obnoveno z: thoughtco.com
- Kurtus R. (19. září 2016). Polární a nepolární molekuly. Škola pro šampiony. Obnoveno z: school-for-champions.com
- Ganong W. (2004). Lékařská fyziologie. Vydání 19Čt. Redakce moderního manuálu.


Zatím žádné komentáře