
Historie nekovů, vlastnosti, skupiny, použití
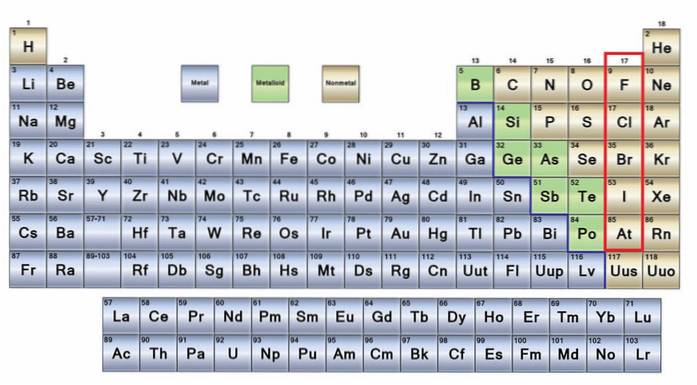
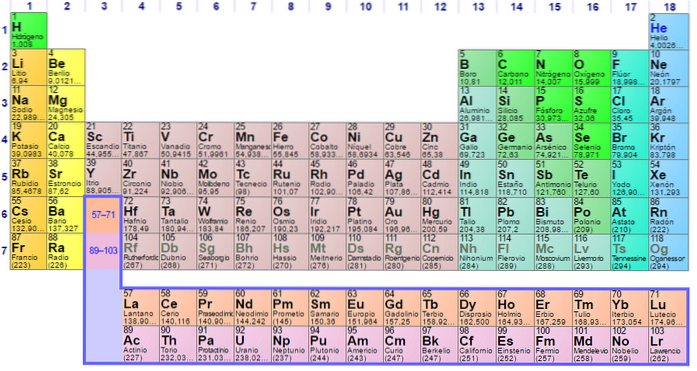
The žádné kovy Jedná se o skupinu prvků, které se nacházejí na pravé straně periodické tabulky, s výjimkou vodíku, který se nachází ve skupině 1 (IA), spolu s alkalickými kovy. Pokud chcete vědět, o co jde, musíte se podívat do pravého horního rohu bloku p.
Nekovové atomy jsou relativně malé a jejich vnější elektronický obal má vysoký počet elektronů. Mezi nekovovými prvky mohou být pevné látky, kapaliny a plyny; ačkoli většina z nich je v plynném stavu, několik z nich obohacuje atmosféru.
Velká část nekovů je přítomna u všech živých bytostí ve formě sloučenin a makromolekul. Například: uhlík, kyslík a vodík jsou přítomny ve všech bílkovinách, lipidech, sacharidech a nukleových kyselinách.
Fosfor je přítomen ve všech nukleových kyselinách a v některých sacharidech a lipidech. Síra se nachází v mnoha bílkovinách. Dusík je součástí všech nukleových kyselin a bílkovin.
Na druhé straně jsou podzemí, metanové plyny a ropa složeny téměř výhradně z nekovových prvků. Ve skutečnosti poskytují uhlovodíky (uhlík a vodík) představu o tom, jak hojné jsou nekovy, i přes jejich nižší počet prvků v periodické tabulce..
Rejstřík článků
- 1 Historie
- 2 Fyzikální a chemické vlastnosti
- 2.1 Fyzika
- 2.2 Chemie
- 3 Skupiny nekovů a prvků
- 3.1 Skupina 1
- 3.2 Skupina 14
- 3.3 Skupina 15
- 3.4 Skupina 16
- 3.5 Skupina 17
- 3.6 Skupina 18
- 4 použití
- 4.1 Vodík
- 4.2 Uhlík
- 4.3 Dusík
- 4.4 Fosfor
- 4.5 Kyslík
- 4.6 Síra
- 4.7 Selen
- 4.8 Fluor
- 4,9 Chlor
- 4.10 Brom
- 4.11 Jód
- 4.12 Hélium
- 4.13 Neon
- 4.14 Argon
- 4,15 Xenon
- 4,16 Radon
- 5 Reference
Příběh
Od starověku (3750 př. N. L.) Používali Egypťané uhlí ke snížení obsahu mědi v minerálech, jako je corvellit a malachit..
V roce 1669 se společnosti Hennin Brand podařilo izolovat fosfor ze shromážděné moči. Henrymu Cavendishovi (1776) se podařilo identifikovat vodík, ačkoli několik vědců, včetně Roberta Boylea (1670), vyrábělo vodík reakcí silné kyseliny s kovem.
Carl Scheele produkoval kyslík zahříváním oxidu rtuti dusičnany (1771). Curtoisovi se podařilo izolovat jód, zatímco se pokoušel připravit ledek z mořských řas (1811). Balard a Gmelin izolovali brom (1825).
V roce 1868 Janssen a Lockger nezávisle objevili helium pozorováním žluté čáry při studiu spektra slunečního světla, které nepatřilo jinému prvku. Moissanu se podařilo izolovat fluorid (1886).
V roce 1894 Lord Rayleigh a Ramsey objevili argon studiem vlastností dusíku. Ramsay a Travers (1898) izolovali krypton, neon a xenon z kapalného argonu kryogenní destilací vzduchu..
Fyzikální a chemické vlastnosti

Fyzický
Některé fyzikální vlastnosti nekovů jsou:
-Mají nízkou elektrickou vodivost, s výjimkou uhlíku ve formě grafitu, který je dobrým vodičem elektřiny..
-Mohou se objevit pod fyzickým vzhledem pevných látek, kapalin nebo plynů.
-Mají nízkou tepelnou vodivost, s výjimkou uhlíku ve formě diamantu, který se nechová jako tepelný izolátor..
-Mají nízký lesk, na rozdíl od kovového lesku kovů.
-Nekovové pevné látky jsou křehké, takže nejsou tvárné ani tvárné.
-Mají nízkou teplotu tání a teplotu varu.
-Mohou mít různé krystalické struktury. Fosfor, kyslík a fluor mají tedy krychlovou krystalickou strukturu; vodík, uhlík a dusík, šestihranný; a síra, chlor, brom a jod, ortorombické.
Chemie
Nekovy se vyznačují vysokou ionizační energií a vysokou hodnotou elektronegativity. Například fluor má nejvyšší elektronegativitu (3,98) a je nejreaktivnějším prvkem nekovů.
Překvapivě však mají nejvyšší elektronegativitu vzácné plyny helium (5,5) a neon (4,84). Jsou však chemicky inertní, protože vnější elektronické skořápky jsou vyplněny..
Nekovy tvoří iontové sloučeniny s kovy a kovalentní s nekovy.
Nekovové prvky se nalézají a tvoří diatomické molekuly spojené kovalentní vazbou. Atomy vzácných plynů jsou zatím ve formě atomových jednotek.
Tvoří kyselé oxidy, které při reakci s vodou vytvářejí kyseliny.
Nekovové skupiny a prvky
Skupina 1
Je složen z vodíku, bezbarvého plynu bez zápachu, křemeliny. Oxidační stav +1. Má nižší hustotu než vzduch. V pevném stavu má hexagonální krystalickou strukturu. Vodík je špatně reaktivní prvek.
Skupina 14
Uhlík je jediným nekovem v této skupině. Uhlík ve formě grafitu je lesklá pevná látka s hexagonální krystalickou strukturou. Má vysokou elektrickou vodivost. Jeho nejběžnější oxidační stavy jsou +2 a +4.
Skupina 15
Dusík
Bezbarvý plyn bez zápachu. Je to mírně reaktivní prvek a mírně hustší než vzduch. Nejběžnější oxidační stavy: -3 a +5. Tvoří diatomické molekuly, Ndva.
Zápas
Plná, její barva může být bílá, žlutá nebo černá. Trochu reaktivní. Ortorombická krystalová struktura. Elektronegativita 2.1. Nejběžnější oxidační stavy: -3 a +5.
Skupina 16
Kyslík
Bezbarvý nebo světle modrý plyn, bez zápachu. Obecně nereaktivní. Krychlová krystalová struktura. Je to izolátor a silné oxidační činidlo. Elektronegativita 3.5. Oxidační stav -2
Síra
Zářivě žlutá pevná látka, křehká, středně reaktivní. Ortorombická krystalová struktura. Vytváří kovalentní vazby. Elektronegativita 2.5. Nejběžnější oxidační stavy: -2, +2, +4 a +6.
Selen
Plná šedá nebo načervenalá až černá. Šedý selen vykazuje elektrickou vodivost citlivou na světlo. Je to měkká a křehká pevná látka. Elektronegativita 2.4. Oxidační stavy: -2, +2, +4 a +6.
Skupina 17
Fluor
Je to světle žlutý plyn, velmi toxický. Je to velmi reaktivní prvek. Vyskytuje se jako diatomické molekuly, Fdva. V pevném stavu krystalizuje v kubické formě. Elektronegativita 3,98. Oxidační stavy -1.
Chlór
Je to zelenožlutý plyn. Představuje diatomické molekuly, Cldva. Je to velmi reaktivní. V pevném stavu je krystalická struktura ortorombická. Elektronegativita 3.0. Oxidační stavy: - 1, +1, +3, +5, +7.
Bróm
Je to červenohnědá kapalina. Elektronegativita 2.8. Oxidační stavy -1, +1, +3, +5 a +7.
Jód
Je to černá pevná látka, která při sublimaci vydává fialovou páru. Ortorombická krystalová struktura. Jodidy kovů jsou iontové. Elektronegativita 2.5. Oxidační stavy: -1, +1, +3, +5 a +7.
Astatus
Je to plná černá. Struktura krychlového krystalu zaměřená na obličej. Elektronegativita 2.2. Je to slabé oxidační činidlo.
Skupina 18
Hélium
Má vysokou tepelnou vodivost. Elektronegativita 5.5. Je chemicky inertní a nehořlavý. Nízká hustota a vysoká tekutost.
Neon
Vysoký chladicí výkon v kapalném stavu. Elektronegativita 4,84. Je nejméně reaktivní z drahých plynů.
Argon
Je hustší než vzduch. Chemicky inertní. Elektronegativita 3.2.
Krypton
Elektronegativita 2,94. Může reagovat s fluorem za vzniku krypton-difluoridu (KrFdva).
Xenon
Překračuje hematoencefalickou bariéru. Reaguje na elektrický proud produkcí světla. Elektronegativita 2.2. Tvoří komplexy s fluorem, zlatem a kyslíkem.
Radon
Je to radioaktivní prvek. Elektronegativita 2,06. Tvoří sloučeniny s fluorem (RnFdva) a s kyslíkem (RnO3).
Aplikace
Vodík
Používá se v raketovém pohonu a jako palivo v motorech automobilů, které používají vodík. Používá se při syntéze amoniaku (NH3) a při hydrogenaci tuků.
Uhlík

Grafit se používá při výrobě tužek a vysoce pevných vláken, která se používají při výrobě sportovních potřeb. Diamant se používá jako drahokam s velkou hodnotou a ve vrtaných dírách jako brusivo. Oxid uhličitý se používá při výrobě sycených nápojů.
Dusík
Používá se při výrobě amoniaku, kyseliny dusičné a močoviny. Dusík je základním prvkem rostlin a používá se při výrobě hnojiv.
Zápas
Bílý fosfor se používá jako rodenticid, insekticid a v průmyslu ohňostrojů. Červený fosfor se používá k výrobě zápalek. Jeho sloučeniny se také používají při výrobě hnojiv.
Kyslík
Kyslík se používá při výrobě oceli, plastů a textilií. Používá se také v raketových pohonných látkách, kyslíkové terapii a pomoci s dýcháním v letadlech, ponorkách a kosmických letech..
Síra
Používá se jako surovina pro výrobu kyseliny sírové, střelného prachu a při vulkanizaci kaučuků. Siřičitany se používají k bělení papíru a fungicidů.
Selen
Používá se k dodání šarlatově červeného odstínu sklu. Používá se také k neutralizaci nazelenalého odstínu vzniklého kontaminací skla sloučeninami železa. Používá se ve fotoelektrických článcích s aplikací ve dveřích a výtazích.
Fluor

Přidává se do zubních past, aby se zabránilo dutinám. Jako surovina pro teflon se používá fluorovodík. Monatomický fluor se používá při výrobě polovodičů.
Chlór
Používá se v extrakční metalurgii a při chloraci uhlovodíků pro výrobu různých produktů, jako je PVC. Chlór se používá v buničině na dřevo a na textil. Používá se také jako dezinfekční prostředek na vodu.
Bróm
Používá se při přípravě bromidu stříbrného pro čočky citlivé na světlo a ve fotografickém filmu. Používá se také při výrobě sedativního bromidu sodného a dibromethanu, což je protiblokovací složka benzínu..
Jód
Přidá se jodid draselný (KI), aby se zabránilo strumě štítné žlázy. Tinktura jódu se používá jako antiseptikum a germicid. Jód je součástí hormonů štítné žlázy.
Hélium
Používá se při plnění horkovzdušných balónů a ve směsi s kyslíkem pro hluboké vodní dýchání. Používá se pro svařování v inertní atmosféře a také pomáhá udržovat při výzkumu velmi nízké teploty.
Neon
Ve skleněných trubičkách osvětlených působením elektřiny (červená neonová světla).
Argon
Slouží k vytvoření atmosféry pro svařování a při plnění žárovek.
Xenon
Při výrobě blesků s vysokou intenzitou při krátkých fotografických expozicích se používá směs xenonu a kryptonu.
Radon
Používá se při léčbě rakovinových nádorů radioterapií.
Reference
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Mathews, C. K., van Holde, K. E. a Ahern, K. G. (2002). Biochemie. Třetí edice. Upravit. Pearson-Addison Wesley
- Helmenstine, Anne Marie, Ph.D. (06.10.2019). Jaké jsou vlastnosti nekovů? Obnoveno z: thoughtco.com
- Wikipedia. (2019). Nekovový. Obnoveno z: en.wikipedia.org
- Redaktoři Encyclopaedia Britannica. (5. dubna 2016). Nekovový. Encyklopedie Britannica. Obnoveno z: britannica.com
- José M. Gavira Vallejo. (2016, 27. ledna). Co jsou to polygenní prvky? A ikosageny, krystalógeny, chalkogeny ...? Obnoveno z: triplenlace.com



Zatím žádné komentáře