
Vlastnosti, struktura, použití, rizika oxalátu vápenatého (CaC2O4)
The oxalát vápenatý Je to organická sloučenina tvořená prvky uhlíkem (C), kyslíkem (O) a vápníkem (Ca). Jeho chemický vzorec je CaCdvaNEBO4. Obvykle se vyskytuje ve třech hydratovaných formách: mono-, di- a trihydrát. To znamená, že v krystalické struktuře je jedna, dvě nebo tři molekuly vody..
Šťavelan vápenatý se nachází v minerálech, rostlinách, houbách a jiných živých bytostech, jako jsou savci, a dokonce i u lidí v důsledku metabolismu některých bílkovin. Lze jej nalézt v moči lidí a některých zvířat.
Některá jídla, jako je špenát, rebarbora, sója a čokoláda, obsahují hodně oxalátů, a když je konzumují citliví lidé, mohou se v ledvinách tvořit kameny oxalátu vápenatého..
Kamenům CaC lze zabránitdvaNEBO4 v ledvinách, pokud přijímají velké množství tekutin, zejména vody, vyhýbají se jídlům s vysokým obsahem oxalátů a konzumují potraviny bohaté na vápník a hořčík.
Oxalát vápenatý tvoří nežádoucí vodní kámen v potrubích a nádržích v procesech, jako je výroba buničiny a papíru, a také v pivovarech.
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Specifická hmotnost
- 3.5 Rozpustnost
- 3,6 pH
- 3.7 Chemické vlastnosti
- 4 Přítomnost v přírodě
- 4.1 V minerálech
- 4.2 U rostlin a hub
- 5 Přítomnost v lidském těle a savcích
- 5.1 U lidí
- 5.2 Faktory, které ovlivňují vzhled kamenů v ledvinách
- 5.3 Způsoby, jak zabránit tvorbě kamenů šťavelanu vápenatého
- 5.4 U zvířat
- 5.5 Reakce těla na přebytek oxalátu
- 6 použití
- 6.1 Problémy v některých procesech
- 7 Rizika
- 8 Reference
Struktura
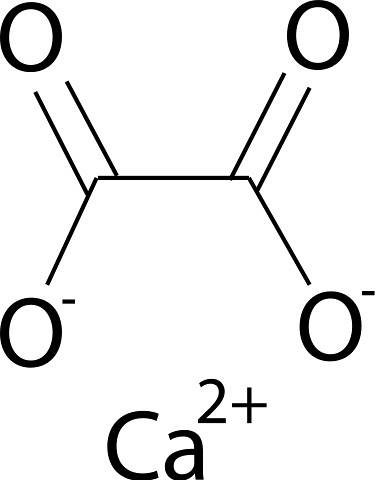
Šťavelan vápenatý je tvořen iontem vápníku Cadva+ a oxalátový iont CdvaNEBO4dva-. Oxalátový anion se skládá ze dvou atomů uhlíku a čtyř atomů kyslíku. Negativní náboje oxalátového aniontu se nacházejí na atomech kyslíku.
Nomenklatura
- Šťavelan vápenatý
- Vápenatá sůl kyseliny šťavelové
- Vápenatá sůl kyseliny ethandiové
Vlastnosti
Fyzický stav
Bezbarvá, bílá, žlutá nebo hnědá krystalická pevná látka, která může být ve třech různých hydratovaných formách.
Molekulární váha
128,1 g / mol
Bod tání
Monohydrát oxalátu vápenatého se rozkládá při 200 ° C.
Specifická hmotnost
Monohydrát CaCdvaNEBO4 •HdvaO = 2,22 g / cm3
Dihydrát CaCdvaNEBO4 •2HdvaO = 1,94 g / cm3
Trihydrát CaCdvaNEBO4 •3HdvaO = 1,87 g / cm3
Rozpustnost
Téměř nerozpustný ve vodě: 0,00061 g / 100 g vody při 20 ° C. Monohydrát se rozpouští ve zředěné kyselině.
pH
Vodné roztoky oxalátu vápenatého jsou slabě bazické.
Chemické vlastnosti
Šťavelan vápenatý je vápenatá sůl kyseliny šťavelové. Jedná se o přirozený vedlejší produkt metabolismu, takže je v lidském těle velmi hojný a je součástí mnoha potravin.
Kyselina šťavelová a její konjugovaná báze, oxalát, jsou vysoce oxidované organické sloučeniny s vysokou chelatační aktivitou, to znamená, že se mohou snadno kombinovat s kladnými ionty s náboji +2 nebo +3.
Jeho vodné roztoky jsou slabě bazické, protože oxalátový iont má tendenci přijímat H protony.+ z vody, která uvolňuje ionty OH-. Po požití dvou protonů H+ z oxalátového iontu se stane kyselina šťavelová HdvaCdvaNEBO4:
CdvaNEBO4dva- + HdvaO → HCdvaNEBO4- + Ach-
HCdvaNEBO4- + HdvaO → HdvaCdvaNEBO4 + Ach-
Přítomnost v přírodě
V minerálech
Šťavelan vápenatý je nejběžnějším oxalátem a je dodáván ve formě minerálů, jako je watelit, weddellit a caoxit..
Whewellit je monohydrát CaCdvaNEBO4 •HdvaNebo a je nejstabilnější z forem této sloučeniny.

Weddellit je dihydrát CaCdvaNEBO4 •2HdvaO a je méně stabilní než monohydrát.

Caoxit je trihydrát oxalátu vápenatého CaCdvaNEBO4 •3HdvaNEBO.
V rostlinách a houbách
Šťavelan vápenatý se nalézá spojený se suchými půdami a listy, také s patogenními houbami, volný, v symbióze nebo spojený s rostlinami. V druhém případě se krystaly tvoří vysrážením vápníku ve formě jeho oxalátu..
Tvorba CaCdvaNEBO4 plísněmi má významný vliv na biologické a geochemické procesy půd, protože představuje rezervu vápníku pro ekosystém.
Přítomnost v lidském těle a savcích
Oxalát pochází z jater, červených krvinek nebo erytrocytů a v menší míře z ledvin. Je tvořen metabolismem aminokyselin (jako je fenylalanin a tryptofan) a oxidací glyoxal dialdehydu,.
Při výkonu své antioxidační funkce může být také vitamin C přeměněn na oxalát.
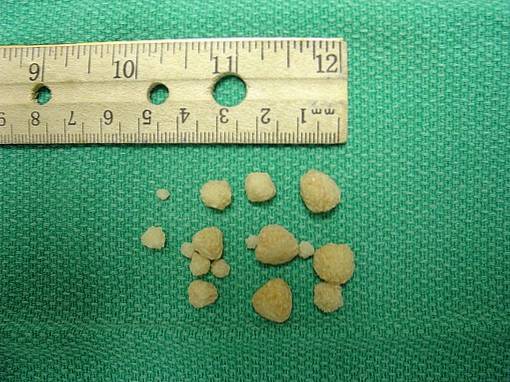
Šťavelan vápenatý se nachází v kamenech, které se tvoří v ledvinách lidí nebo zvířat s onemocněním ledvin..
Takzvané kameny oxalátu vápenatého nebo kameny jsou tvořeny krystalizací nebo agregací CaCdvaNEBO4 v moči přesyceném vápníkem a oxalátem. To znamená, že moč obsahuje tolik vápníku a oxalátu, že není možné, aby tato sloučenina zůstala rozpuštěna, ale aby se vysrážela nebo přešla do pevného stavu ve formě krystalů..
U lidí
Tvorba písku nebo kamenů v ledvinách je onemocnění zvané nefrolitiáza; napadá přibližně 10% populace a přibližně 75% těchto kamenů je složeno z oxalátu vápenatého CaCdvaNEBO4.
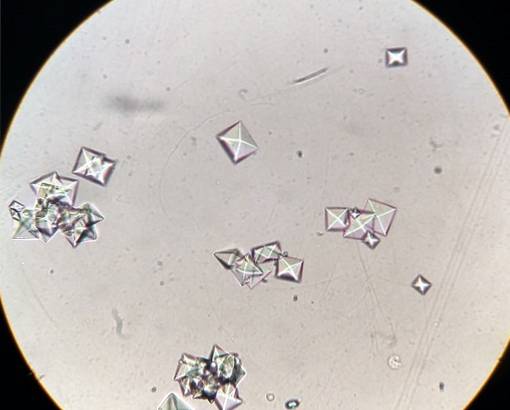
K tvorbě a růstu krystalů šťavelanu vápenatého v ledvinách dochází, protože u některých lidí je moč přesycený touto solí. Šťavelan vápenatý se vyvíjí v kyselé moči při pH nižším než 6,0.
K přesycení dochází, když k vylučování nebo vylučování této soli (která je velmi špatně rozpustná ve vodě) močí dochází v malém množství vody..
Faktory, které ovlivňují vzhled kamenů v ledvinách
Mezi faktory, které podporují tvorbu štěrku šťavelanu vápenatého, patří přebytek vápníku v moči nebo hyperkalciurie, přebytek šťavelanu v moči nebo hyperoxalurie, prvky odvozené ze stravy a absence inhibitorů.
Přebytek oxalátu může nastat, když se konzumuje mimo jiné velké množství špenátu, rebarbory, sóji, ořechů a čokolády..

Existují však látky, které inhibují nebo zabraňují tvorbě kamenů. Mezi sloučeniny, které zabraňují tvorbě kamenů, patří malé molekuly, jako je citrát a pyrofosfát, a velké molekuly, jako jsou glykoproteiny a proteoglykany..
Způsoby, jak zabránit tvorbě kamenů šťavelanu vápenatého
Dobrá strategie, jak zabránit opakování kamínků nebo kamenů šťavelanu vápenatého, zahrnuje zvýšení příjmu tekutin, zvýšení příjmu potravin bohatých na vápník (jako jsou mléčné výrobky) a omezení stolní soli (NaCl), živočišných bílkovin a potravin bohatých na šťavelan..
U zvířat
Od začátku roku 2000 byl v močovém systému koček a psů pozorován nárůst kamenů šťavelanu vápenatého. Zdá se, že to závisí na typu stravy, kterou tato zvířata konzumují, a má co do činění s kyselostí nedostatku moči a hořčíku (Mg).
Reakce těla na přebytek oxalátu
Existují důkazy, že jak lidé, tak zvířata reagují na přebytek oxalátu zvýšením počtu bakterií, které mohou oxalát rozkládat..
Některé z těchto bakterií jsou Oxalobacter formigenes, Bifidobacterium sp., Porphyromonas gingivalis Y Bacillus sp., mimo jiné a jsou přirozeně přítomny ve střevě.
Aplikace
Podle konzultovaných zdrojů se v keramickém povlaku používá oxalát vápenatý.
Používá se k potahování vápencových soch a dalších uměleckých prvků a bylo zjištěno, že zlepšuje tvrdost materiálu, snižuje jeho pórovitost a zvyšuje odolnost vůči kyselinám a zásadám..

Problémy v některých procesech
V celulózo-papírenském průmyslu může oxalát vápenatý tvořit vodní kámen, který v tomto procesu způsobuje mnoho problémů..
Aby se zabránilo jeho tvorbě v potrubích nebo potrubích průmyslových procesů, byla navržena enzymatická degradace kyseliny šťavelové pomocí enzymů, jako je oxalát oxidáza..
Rovněž má tendenci se hromadit jako kámen v nádobách, kde se vyrábí pivo, odkud musí být vyloučeno, aby se zabránilo tvorbě mikroorganismů, které mohou nápoju nepříjemně chutnat..
Rizika
Ve vysokých koncentracích může oxalát způsobit smrt u zvířat a příležitostně u lidí, zejména kvůli jeho korozivním účinkům..
Nahromadění oxalátu a jeho konjugované kyseliny, kyseliny šťavelové, může způsobit poruchy, jako je srdeční selhání, kameny oxalátu vápenatého, selhání ledvin a dokonce i smrt v důsledku toxicity.
Reference
- Glasauer, S.M. et al. (2013). Kovy a metaloidy, transformace mikroorganismy. Oxaláty. In Reference Module in Earth Systems and Environmental Sciences. Obnoveno ze sciencedirect.com.
- Baumann, J. M. a Casella, R. (2019). Prevence nefrolitiázy vápníku: Vliv diurézy na krystalizaci oxalátu vápenatého v moči. Adv Prev Med, 2019; 2019: 3234867. Obnoveno z ncbi.nlm.nih.gov.
- Breshears, M.A. a Confer, A.W. (2017). Močový systém. Kalkal oxalátu vápenatého. In Pathologic Basis of Veterinary Disease (šesté vydání). Obnoveno ze sciencedirect.com.
- Huang, Y. er al. (2019). Tge Manipulace s oxalátem v těle a těle Původ oxalátu v kalcium oxalátových kamenech. Urol Int, 2019 5. prosince: 1–10. Obnoveno z ncbi.nlm.nih.gov.
- Nilvebrant, N.-O. et al. (2002). Biotechnologie v průmyslu papíru a celulózy. Probíhá biotechnologie. Obnoveno ze sciencedirect.com.
- Pahira, J.J. a Pevzner, M. (2007). Nefrolitiáza. Vápníkové kameny. In Penn Clinical Manual of Urology. Obnoveno ze sciencedirect.com.
- Worcester, E. M. (1994). Inhibitory růstu krystalů oxalátu vápenatého v moči. J Am Soc Nephrol 1994 listopad; 5 (5 Suppl 1): S46-53). Obnoveno z jasn.asnjournals.org.
- Finkielstein, V.A. a Goldfarb, D.S. (2006). Strategie prevence kamenů oxalátu vápenatého. Obnoveno z ncbi.nlm.nih.gov.
- NÁS. Národní lékařská knihovna. (2019). Šťavelan vápenatý. Obnoveno z pubchem.ncbi.nlm.nih.gov.
- Peck, A.B. et al. (2015). Mikroorganismy degradující oxalát nebo enzymy degradující oxalát: Jaká je budoucí terapie pro enzymatické rozpouštění urolitů oxalátu vápenatého při recidivující kamenné nemoci? Urolitiáza, 2016 únor; 44 (1): 27-32. Obnoveno z ncbi.nlm.nih.gov.
- Holames, R.P. et al. (2016). Snížení vylučování šťavelanu močí ke snížení onemocnění kamenů šťavelanu vápenatého. Urolitiáza. 2016 únor; 44 odst. 1; 27-32. Obnoveno z ncbi.nlm.nih.gov.
- Cezar, T.M. (1998). Oxalát vápenatý: povrchová úprava vápence. Journal of Conservation and Museum Studies 4, s. 6-10. Obnoveno z jcms-journal.com.
- Wikimedia (2019). Oxalát vápenatý. Obnoveno z en.wikipedia.org.

Zatím žádné komentáře