
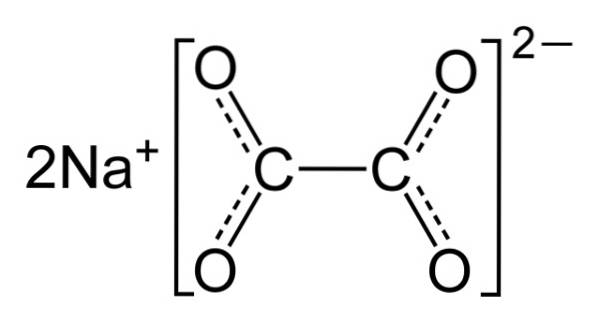
Struktura, vlastnosti, použití, rizika oxalátu sodného (Na2C2O4)
The šťavelan sodný Je to organická sloučenina složená ze dvou iontů sodíku a jednoho oxalátového iontu. Jeho chemický vzorec je NadvaCdvaNEBO4 nebo také Nadva(VRKAT)dva. Je to sodná sůl kyseliny šťavelové nebo kyseliny ethandiové. PakdvaCdvaNEBO4 je bílá krystalická pevná látka a její vodné roztoky jsou zásadité (zásadité).
Šťavelan sodný je přítomen v rostlinách a zelenině. U lidí je kyselina šťavelová přirozeně generována z její konjugované kyseliny, která je zase produkována určitými metabolickými procesy.

PakdvaCdvaNEBO4 Používá se v laboratořích pro chemickou analýzu jako redukční činidlo (opak oxidantu). Také umožnit testování určitých organických sloučenin během čištění odpadních vod.
Používá se k likvidaci odpadu z chlorfluoruhlovodíků (CGC), který poškozuje ozonovou vrstvu. Je to také surovina k ekonomickému získání kyseliny šťavelové.
Vzhledem k vysokému obsahu šťavelanu sodného v některé jedlé zelenině by lidé, kteří mají sklon k tvorbě kamenů nebo ledvinových kamenů, neměli konzumovat takové potraviny. Je to proto, že kameny jsou obvykle tvořeny oxaláty..
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Hustota
- 3.4 Rozpustnost
- 3,5 pH
- 3.6 Chemické vlastnosti
- 4 Získání
- 4.1 Přítomnost v přírodě
- 5 použití
- 5.1 V laboratořích pro chemickou analýzu
- 5.2 Při ničení chlorfluoruhlovodíků
- 5.3 Při určování důležitých parametrů při čištění odpadních vod
- 5.4 Získat kyselinu šťavelovou
- 5.5 Odstranit nežádoucí sloučeniny
- 6 Rizika
- 7 Reference
Struktura
Šťavelan sodný se skládá ze dvou sodných kationtů Na+ a oxalátový anion (COO)dvadva-. Oxalátový anion je zase tvořen dvěma jednotkami COO- vázané prostřednictvím dvou atomů uhlíku: -OOC-COO-.
V pevném oxalátu sodném má oxalátový anion plochý tvar. To znamená, že uhlíky i kyslíky jsou ve stejné rovině..
Nomenklatura
- Šťavelan sodný
- Šťavelan disodný
- Sodná sůl kyseliny ethandiové
Vlastnosti
Fyzický stav
Pevná bílá krystalická.
Molekulární váha
134,0 g / mol
Hustota
2,27 g / cm3 při 20 ° C.
Rozpustnost
Rozpustný ve vodě: 3,7 g / 100 ml při 20 ° C.
pH
Jeho vodné roztoky jsou zásadité (alkalické), protože oxalátový anion má tendenci přijímat protony z vody a ponechávat volné ionty OH.-.
Chemické vlastnosti
Může neutralizovat kyseliny a reakce jsou exotermické, to znamená, že vydávají teplo.
Slouží jako redukční činidlo a při těchto reakcích generuje oxid uhličitý COdva.
Má vlastnost silného vázání na různé ionty kovů, jako jsou ionty železa Fedva+ a železitý Fe3+.
Získávání
Podle konzultovaného zdroje lze oxalát sodný získat oxidací uhlíku kyslíkem Odva při teplotě asi 250 ° C v koncentrovaném roztoku hydroxidu sodného NaOH.
Přítomnost v přírodě
Šťavelan sodný je přítomen v mnoha rostlinách a zelenině, jako je mangold, špenát a rebarbora, a v zrnech, jako jsou sójové boby, mezi mnoha dalšími rostlinnými produkty..

Jeho konjugovaná kyselina, kyselina šťavelová, se v lidském těle vyrábí metabolismem kyseliny glykolové nebo kyseliny askorbové. Jakmile je vyroben, není metabolizován, ale je vylučován močí ve formě oxalátu..

Aplikace
V laboratořích pro chemickou analýzu
Používá se jako chemické činidlo, obecně jako redukční činidlo, například pro standardizaci roztoků manganistanu draselného, to znamená k přesnému určení, kolik manganistanu sodného mají.
Při ničení chlorfluoruhlovodíků
Šťavelan sodný se používá k destrukci chlorfluoruhlovodíků (CFC). Tyto CFC sloučeniny byly jednou z těch, které jsou zodpovědné za ničení ozonové vrstvy planety (která nás chrání před ultrafialovým zářením).
V roce 1996 navrhli někteří vědci použití oxalátu sodného k jejich eliminaci, protože snadno reaguje s CFC při teplotách 270 - 290 ° C, což je činí neškodnými pro ozonovou vrstvu..
Reakci šťavelanu sodného s CFC lze řídit za získání halogenovaných aromatických uhlovodíků, které nejsou škodlivé pro ozonovou vrstvu, ale jsou užitečnými sloučeninami v chemickém průmyslu..
Uvedenou reakci lze také maximalizovat a převést veškerý CFC na fluorid sodný NaF, chlorid sodný NaCl, elementární uhlík a oxid uhličitý CO.dva.

Při určování důležitých parametrů při čištění odpadních vod
Bylo zjištěno, že šťavelan sodný je užitečný při měření množství a druhů organických sloučenin vylučovaných mikroorganismy z kalu používaného k čištění odpadních vod..
Měření těchto sloučenin je důležité pro stanovení jejich funkce během čištění odpadních vod, protože na nich závisí snadné oddělení kalu od vody..
Použití šťavelanu sodného se vyhne nevýhodám jiných metod.
K získání kyseliny šťavelové
Surový oxalát sodný z určitých odpadů z procesu byl použit k výrobě kyseliny šťavelové HdvaCdvaNEBO4 ve velkém množství.
Tato metoda využívá kal z Bayerova procesu k úpravě bauxitu (hliníkové rudy). V Bayerově procesu je bauxit zpracován hydroxidem sodným NaOH, aby se rozpustil oxid hlinitý tohoto minerálu.
V procesu rozpouštění oxidu hlinitého jsou určité organické sloučeniny přítomné v minerálech, jako jsou huminové kyseliny, napadány NaOH, čímž se vytváří velké množství šťavelanu sodného NadvaCdvaNEBO4.
Tento šťavelan sodný je zabudován do bahna se sloučeninami hliníku. K jeho vyčištění se celek rozpustí, filtruje a vede přes iontoměničovou kolonu kyselého typu..
Ve sloupci je pryskyřice RSO s kyselinou sulfonovou3H, kde se vyměňují kovové ionty Na+ vodíkovými ionty H+, takže dostanete kyselinu šťavelovou HdvaCdvaNEBO4.
RSO3H + NadvaCdvaNEBO4 ⇔ RSO3Na + NaHCdvaNEBO4
RSO3H + NaHCdvaNEBO4 ⇔ RSO3Na + HdvaCdvaNEBO4
Jedná se o levný proces a získaná kyselina šťavelová je v přijatelné čistotě..
Odstranit nežádoucí sloučeniny
Konjugovaná kyselina šťavelan sodný, kyselina šťavelová HdvaCdvaNEBO4, slouží k rozpuštění určitých druhů úlomků a vodního kamene.
Využívá vlastnosti kyseliny šťavelové k přeměně na oxalát působící jako komplexační nebo srážecí činidlo, například při zpracování odpadu z různých jaderných paliv.
Kyselina šťavelová se také používá k odstraňování minerálních vodních kamenů a oxidů železa z potrubí a jiných zařízení, což je způsobeno její schopností silně vázat jak železný ion Fedva+ pokud jde o železitý ion Fe3+ tvoří oxaláty.
Rizika
Při přímém vdechnutí nebo požití šťavelan sodný způsobí bolest v krku, jícnu a žaludku. Produkuje zvracení, silné proplachování, slabý puls, kardiovaskulární kolaps, neuromuskulární příznaky a poškození ledvin.
Lidé, kteří mají sklon k tvorbě ledvinových kamenů v důsledku hromadění oxalátu v moči, by se měli vyvarovat konzumace zeleniny s vysokým obsahem rozpustných oxalátů, jako je sodík.
Šťavelan sodný ve velkém množství v potravinách, když se dostane do moči, váže se na přítomný vápník a může u lidí, kteří k tomu mají sklon, způsobit v ledvinách kameny nebo kameny oxalátu vápenatého..
Reference
- NÁS. Národní lékařská knihovna. (2019). Šťavelan sodný. Národní centrum pro biotechnologické informace. Obnoveno z pubchem.ncbi.nlm.nih.gov.
- Chai, W. a Liebman, M. (2005). Vliv různých metod vaření na obsah rostlinného šťavelanu. J. Agric. Food Chem.2005, 53, 3027-3030. Obnoveno z pubs.acs.org.
- Dagani, R. (1996). Reakce ničící CFC. Archiv zpráv o chemikáliích a strojírenství 1996, 74, 4, 6-7. Obnoveno z pubs.acs.org.
- Sajjad, M. a Kim, K.S. (2016). Extrakce extracelulárních polymerních látek z aktivovaného kalu za použití šťavelanu sodného. Int. J. Environ. Sci. Technol. 13, 1697-1706 (2016). Obnoveno z odkazu.springer.com.
- Jeffrey, G.A. a Parry, G.S. (1954). Krystalová struktura oxalátu sodného. J. Am. Chem. Soc. 1954, 76, 21, 5283-5286. Obnoveno z pubs.acs.org.
- Okuwaki, A. a kol. (1984). Výroba oxalátu oxidací uhlí uhlíkem v koncentrovaném roztoku hydroxidu sodného. Ind. Eng. Chem. Prod. Res. Dev. 1984, 23, 648-651. Obnoveno z pubs.acs.org.
- Hefter, G. a kol. (2018). Rozpustnost oxalátu sodného v koncentrovaných elektrolytických roztocích. J Chem & Eng Data. 2018, 63, 3, 542-552. Obnoveno z pubs.acs.org.
- The, K. I. (1992). Způsob přípravy kyseliny šťavelové a hydrogenoxalátu sodného ze surového oxalátu sodného. NÁS. Patent č. 5,171,887. 15. prosince 1992. Obnoveno z freepatentsonline.com.


Zatím žádné komentáře