
Vlastnosti butenu, chemická struktura a použití
The buten je název série čtyř izomerů s chemickým vzorcem C4H8. Jsou to alkeny nebo olefiny, to znamená, že mají ve své struktuře dvojnou vazbu C = C. Kromě toho se jedná o uhlovodíky, které lze nalézt v ropných polích nebo vznikají tepelným krakováním a získávají produkty s nižší molekulovou hmotností..
Čtyři izomery reagují s kyslíkem, uvolňují teplo a žlutý plamen. Stejně tak mohou reagovat se širokým spektrem malých molekul, které přispívají k jejich dvojné vazbě..
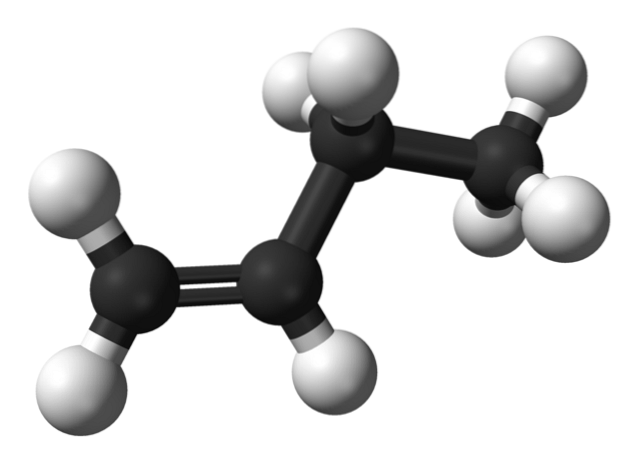
Ale jaké jsou izomery butenu? Na horním obrázku je struktura znázorněna bílou (vodíky) a černou (uhlíky) koulí pro 1-buten. 1-Buten je nejjednodušší izomer uhlovodíku C4H8. Všimněte si, že existuje osm bílých koulí a čtyři černé koule, což souhlasí s chemickým vzorcem.
Dalšími třemi izomery jsou cis a trans 2-buten a iso-buten. Všechny vykazují velmi podobné chemické vlastnosti, i když jejich struktury způsobují rozdíly ve fyzikálních vlastnostech (teploty tání a varu, hustoty atd.). Rovněž jejich IR spektra mají podobné vzory absorpčních pásem..
Hovorově je 1-buten pojmenován jako buten, ačkoli 1-buten odkazuje pouze na jediný izomer a ne na obecný název. Tyto čtyři organické sloučeniny jsou plyny, ale mohou se zkapalnit při vysokých tlacích nebo kondenzovat (a dokonce i krystalizovat) se snížením teploty..
Jsou zdrojem tepla a energie, činidly pro syntézu dalších organických sloučenin a především nezbytnými pro výrobu umělého kaučuku po syntéze butadienu..
Rejstřík článků
- 1 Vlastnosti butenu
- 1.1 Molekulová hmotnost
- 1.2 Fyzické aspekty
- 1.3 Bod varu
- 1.4 Bod tání
- 1.5 Rozpustnost
- 1.6 Hustota
- 1.7 Reaktivita
- 2 Chemická struktura
- 2.1 Konstituční a geometrické izomery
- 2.2 Stabilita
- 2.3 Mezimolekulární síly
- 3 použití
- 4 Odkazy
Butenové vlastnosti
Molekulární váha
56,106 g / mol. Tato hmotnost je stejná pro všechny izomery vzorce C.4H8.
Fyzické aspekty
Je to bezbarvý a hořlavý plyn (jako ostatní izomery) a má relativně aromatický zápach..
Bod varu
Body varu pro izomery butenu jsou následující:
1-Buten: -6 ° C
Cis-2-buten: 3,7 ° C
Trans-2-buten: 0,96 ° C
2-methylpropen: -6,9 ° C
Bod tání
1-Buten: -185,3 ° C
Cis-2-buten: -138,9 ° C
Trans-2-buten: -105,5 ° C
2-methylpropen: -140,4 ° C
Rozpustnost
Buten je ve vodě velmi nerozpustný díky své nepolární povaze. Dokonale se však rozpouští v některých alkoholech, benzenu, toluenu a etherech..
Hustota
0,577 při 25 ° C Proto je méně hustý než voda a v nádobě by byl umístěn nad ním..
Reaktivita
Jako každý alken je jeho dvojná vazba náchylná k přidávání molekul nebo oxidaci. Díky tomu je buten a jeho izomery reaktivní. Na druhou stranu jsou to hořlavé látky, takže při přehřátí reagují s kyslíkem ve vzduchu..
Chemická struktura
Na horním obrázku je znázorněna struktura 1-butenu. Vlevo vidíte umístění dvojné vazby mezi prvním a druhým uhlíkem. Molekula má lineární strukturu, i když oblast kolem vazby C = C je plochá kvůli sp hybridizacidva těchto uhlíků.
Pokud by se molekula 1-butenu otáčela pod úhlem 180 °, měla by stejnou molekulu bez zjevných změn, proto jí chybí optická aktivita.
Jak by jeho molekuly interagovaly? Vazby C-H, C = C a C-C jsou apolární povahy, takže žádná z nich nespolupracuje při tvorbě dipólového momentu. Následkem toho molekuly CHdva= CHCHdvaCH3 musí interagovat pomocí londýnských rozptylových sil.
Pravý konec butenu tvoří okamžité dipóly, které na krátkou vzdálenost polarizují sousední atomy sousední molekuly. Levý konec vazby C = C interaguje tím, že překrývá π mraky jeden na druhého (jako dva plátky nebo listy).
Protože molekulární kostru tvoří čtyři atomy uhlíku, jejich interakce jsou sotva dost na to, aby kapalná fáze měla bod varu -6 ° C..
Konstituční a geometrické izomery
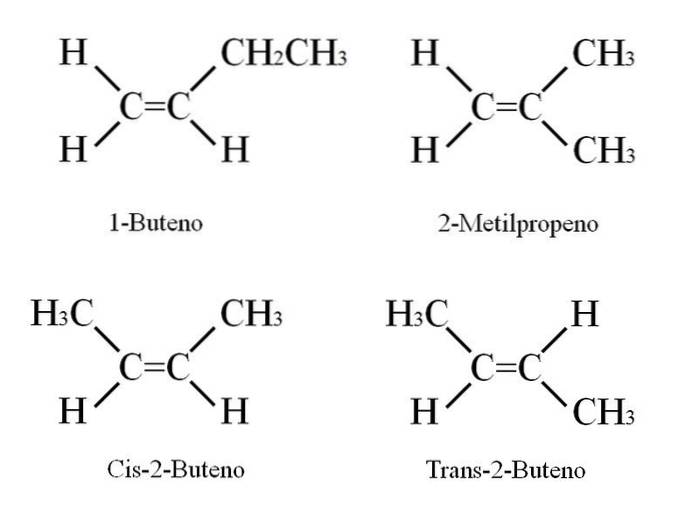
1-Buten má molekulární vzorec C4H8; Jiné sloučeniny však mohou mít ve své struktuře stejný podíl atomů C a H..
Jak je to možné? Pokud je struktura 1-butenu pečlivě sledována, mohou být substituenty na uhlících C = C vyměněny. Tato výměna produkuje další sloučeniny ze stejné kostry. Kromě toho se poloha dvojné vazby mezi C-1 a C-2 může posunout směrem k C-2 a C-3: CH3CH = CHCH3, 2-buten.
Ve 2-butenu mohou být atomy H umístěny na stejné straně dvojné vazby, která odpovídá cis stereoizomeru; nebo v opačné prostorové orientaci v trans stereoizomeru. Oba tvoří to, co je také známé jako geometrické izomery. Totéž platí pro -CH skupiny3.
Všimněte si také, že pokud by zůstalo v molekule CH3CH = CHCH3 atomy H na jedné straně a skupiny CH3 v jiném by byl získán konstituční izomer: CHdva= C (CH3)dva, 2-methylpropen (také známý jako iso-buten).
Tyto čtyři sloučeniny mají stejný vzorec C.4H8 ale různé struktury. 1-Buten a 2-methylpropen jsou konstituční izomery; a cis a trans-2-buten, geometrické izomery mezi nimi dvěma (a ústavní s ohledem na zbytek).
Stabilita
Spalné teplo
Na obrázku výše, který ze čtyř izomerů představuje nejstabilnější strukturu? Odpověď lze najít například ve spalovacích horúčavách každé z nich. Reakcí s kyslíkem je izomer vzorce C.4H8 se změní na COdva uvolňování vody a tepla:
C4H8(g) + 6Odva(g) => 4COdva(g) + 4HdvaO (g)
Spalování je exotermické, takže čím více tepla se uvolňuje, tím je nestabilnější uhlovodík. Proto bude jeden ze čtyř izomerů, které při hoření na vzduchu uvolňují nejméně tepla, nejstabilnější..
Teploty spalování pro čtyři izomery jsou:
-1-Buten: 2717 kJ / mol
-cis-2-buten: 2710 kJ / mol
-trans-2-buten: 2707 kJ / mol
-2-methylpropen: 2700 kJ / mol
Všimněte si, že 2-methylpropen je izomer, který vydává nejméně tepla. Zatímco 1-buten uvolňuje více tepla, což se projevuje větší nestabilitou.
Sterický a elektronický efekt
Tento rozdíl ve stabilitě mezi izomery lze odvodit přímo z chemické struktury. Podle alkenů ten, který má více R substituentů, získá větší stabilizaci své dvojné vazby. 1-buten je tedy nejstabilnější, protože těžko má substituent (-CHdvaCH3); to znamená, že je monosubstituovaný (RHC = CHdva).
Cis a trans izomery 2-butenu se liší energií v důsledku napětí Van der Wall způsobeného stérickým účinkem. V cis izomeru jsou to dvě skupiny CH3 na stejné straně dvojné vazby se navzájem odpuzují, zatímco v trans izomeru jsou dostatečně daleko od sebe.
Ale proč je potom 2-methylpropen nejstabilnějším izomerem? Protože elektronický efekt se přimlouvá.
V tomto případě, i když se jedná o disubstituovaný alken, dvě skupiny CH3 jsou na stejném uhlíku; ve vzájemné polodrahokamové poloze. Tyto skupiny stabilizují uhlík dvojné vazby a dávají mu část jeho elektronového mraku (protože je relativně kyselejší díky sp hybridizaci).dva).
Navíc ve 2-butenu mají jeho dva izomery pouze 2 ° uhlíky; zatímco 2-methylpropen obsahuje 3. uhlík s vyšší elektronickou stabilitou.
Mezimolekulární síly
Stabilita čtyř izomerů sleduje logické pořadí, ale mezimolekulární síly nikoli. Pokud se porovná jejich teplota tání a teplota varu, zjistí se, že nedodržují stejné pořadí.
Očekávalo by se, že trans-2-buten by představoval nejvyšší mezimolekulární síly kvůli většímu povrchovému kontaktu mezi dvěma molekulami, na rozdíl od cis-2-butenu, jehož kostra čerpá C. cis-2-buten však vře při vyšší teplotě (3,7 ° C), než trans izomer (0,96 ° C).
Lze očekávat podobné teploty varu pro 1-buten a 2-methylpropen, protože jsou strukturně velmi podobné. V pevném stavu se však rozdíl radikálně mění. 1-Buten taje při -185,3 ° C, zatímco 2-methylpropen při -140,4 ° C.
Kromě toho se cis-2-butenový izomer taje při -138,9 ° C, při teplotě velmi blízké 2-methylpropenomu, což může znamenat, že v pevné látce představují stejně stabilní uspořádání.
Z těchto údajů lze usoudit, že navzdory znalosti nejstabilnějších struktur nevrhají dostatek světla na znalosti fungování mezimolekulárních sil v kapalině; a ještě více v pevné fázi těchto izomerů.
Aplikace
-Buteny, vzhledem k jejich spalnému teplu, lze jednoduše použít jako zdroj tepla nebo paliv. Očekává se tedy, že 1-butenový plamen se bude ohřívat více než u ostatních izomerů..
-Lze použít jako organická rozpouštědla.
-Slouží jako přísady ke zvýšení oktanové hladiny benzínu.
-V rámci organické syntézy se 1-buten podílí na výrobě dalších sloučenin, jako jsou: butylenoxid, 2-glutanol, sukcinimid a terc-butylmecaptan (používá se k získání charakteristického zápachu varného plynu). Podobně butadien (CHdva= CH-CH = CHdva), ze kterého je syntetický kaučuk syntetizován.
Kromě těchto syntéz bude rozmanitost produktů záviset na tom, které molekuly jsou přidány k dvojné vazbě. Například alkylhalogenidy mohou být syntetizovány, pokud reagují s halogeny; alkoholy, pokud přidávají vodu v kyselém prostředí; a terc-butylestery, pokud přidávají nízkomolekulární alkoholy (například methanol).
Reference
- Francis A. Carey. Organická chemie. Karboxylové kyseliny. (šesté vydání, strany 863-866). Mc Graw Hill.
- Wikipedia. (2018). Butene Převzato z: es.wikipedia.org
- YPF. (Červenec 2017). Buten us. [PDF]. Převzato z: ypf.com
- William Reusch. (5. května 2013). Adiční reakce Alkenes. Obnoveno z: 2.chemistry.msu.edu
- PubChem. (2018). 1-buten. Obnoveno z: pubchem.ncbi.nlm.nih.gov


Zatím žádné komentáře