
Struktura peroxidu vodíku (H2O2), vlastnosti, použití, výroba
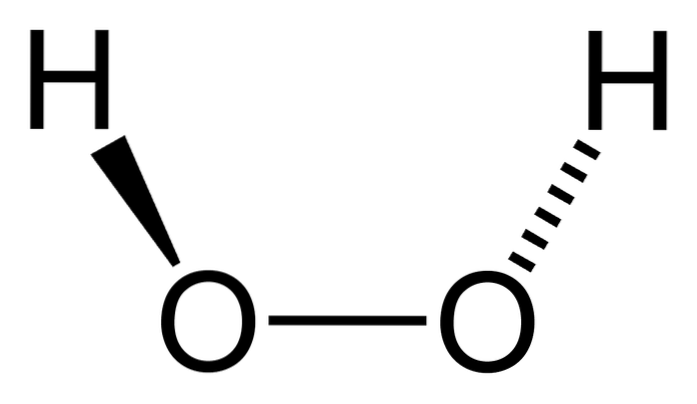
The peroxid vodíku je anorganická sloučenina, jejíž chemický vzorec je HdvaNEBOdva. Ze všeho je to nejjednodušší peroxid z této rodiny chemických sloučenin. Jeho strukturní vzorec je H-O-O-H, což je tento vnitřní okysličený můstek charakteristický pro všechny peroxidy.
V roce 1818 se HdvaNEBOdva Identifikoval to Louies Jacques Thénard, který připravil chemickou sloučeninu, kterou v té době nazýval peroxid vodíku. Je to nestabilní sloučenina, rozkládá se při vystavení světlu, teplu a některým kovům.
Je to velmi užitečná směs, která se používá k dezinfekci drobných ran, bělení vlasů, úpravě vody atd. Ačkoli může mít škodlivé účinky na člověka, nachází se ve všech eukaryotických buňkách živých bytostí, kde plní několik prospěšných funkcí.
Peroxid vodíku produkuje oxidaci toxických látek, jako jsou fenoly, ethanol, formaldehyd atd., Produkty, které jsou vylučovány játry a ledvinami. Kromě toho přispívá k destrukci bakterií fagocytovaných neutrofilními leukocyty a makrofágy..
Rejstřík článků
- 1 Struktura
- 1.1 Molekula
- 1.2 Rotace
- 1.3 Intermolekulární interakce
- 2 Vlastnosti
- 2.1 Jména
- 2.2 Molární hmotnost
- 2.3 Fyzický vzhled
- 2.4 Zápach
- 2.5 Příchuť
- 2.6 Hustota
- 2.7 Teplota tání
- 2.8 Bod varu
- 2.9 Rozpustnost ve vodě
- 2.10 Rozpustnost
- 2,11 Rozdělovací koeficient oktanol / voda
- 2.12 Tlak par
- 2.13 Disociační konstanta
- 2,14 pH
- 2.15 Index lomu (nD)
- 2.16 Viskozita
- 2.17 Tepelná kapacita
- 2.18 Odpařovací teplo
- 2.19 Stabilita
- 2.20 Koroze
- 2.21 Rozklad
- 2.22 Povrchové napětí
- 2.23 Reaktivita
- 3 použití
- 3.1 Bělení
- 3.2 Dezinfekční prostředek
- 3.3 Čisticí prostředek
- 3.4 Kosmetická aplikace
- 3.5 Pohonná látka
- 4 Získání
- 4.1 Hydrogenace
- 4.2 Filtrace
- 4.3 oxidace
- 4.4 Extrakce a čištění
- 5 Rizika
- 6 Reference
Struktura
Molekula
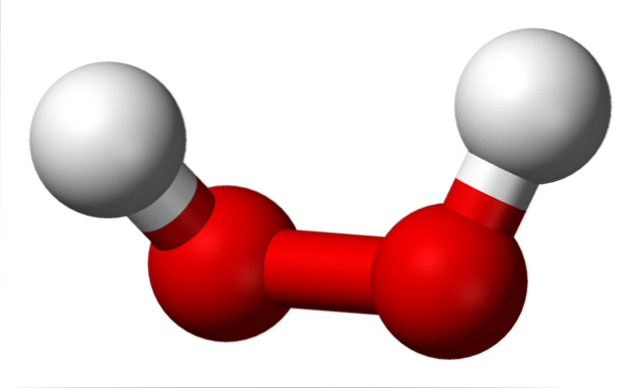
Horní obrázek ukazuje strukturu molekuly HdvaNEBOdva (H-O-O-H), přičemž červené koule odpovídají atomům kyslíku a ty bílé atomy vodíku. Všimněte si, že molekula není plochá a že atomy H nejsou zastíněny v prostoru (jeden před druhým).
Zajímavé je, že do HdvaNEBOdva Je pro ni obtížné otáčet svou centrální jednoduchou O-O vazbu, takže polohy těchto H nelze zaměnit; jeden nebude klesat, zatímco druhý bude stoupat.
Proč? Protože ve dvou atomech kyslíku jsou dva volné páry elektronů, což dává celkem osm velmi blízkých elektronů, které se navzájem odpuzují kvůli svým negativním nábojům..
Rotace
Přesto je vazba O-O náchylná k mírné rotaci v důsledku interakcí s okolním prostředím..
Například spojením obou palců s nataženými ukazováčky a ostatními zavřenými, jako by kreslil kurt, a poté otáčením palců tak, aby jeden z ukazováčků směřoval dopředu a druhý dozadu, mají přibližné zastoupení HdvaNEBOdva.
Pokud se tělo dotkne některého ukazováčku, palce se budou otáčet v reakci na tuto interakci; okamžitě se však vrátí do své původní polohy kvůli elektronickým odpudům uvedeným výše. Tyto rotace tedy rámují dynamické aspekty této molekuly.
Intermolekulární interakce
V kapalném stavu je HdvaNEBOdva dokáže vytvořit vodíkové vazby (HOOH-OdvaHdva), protože jinak by jeho vysoký bod varu (150 ° C) ve srovnání s vodou nebyl vysvětlen.
Jakmile projde do plynné fáze, molekuly H.dvaNEBOdva pravděpodobně již takové mosty nemůže tvořit, a to nejen kvůli větší mezimolekulární vzdálenosti, ale také atomům vodíku by se v případě kolizí jako první dotkly (to lze vizualizovat opětovným použitím modelu prstu).
Mezitím je v pevné fázi úhel rovin stanovených pomocí H 90 ° (ukazováčky položte kolmo). Nyní jsou vodíkové vazby ještě důležitější a molekuly H.dvaNEBOdva jsou uspořádány v krystalu tetragonální struktury.
Vlastnosti
sLáhev s peroxidem vodíku. V lékárnách se toho dosahuje při koncentraci 3% m / v. Zdroj: Pixnio.
Jména
-Peroxid vodíku
-Antioxidan
-Oxidanol
-Kyselina perhydroxová
-O-hydroxyol
-Peroxid
Molární hmotnost
34,0147 g / mol
Fyzický vzhled
Bledě modrá (koncentrovaná) nebo bezbarvá kapalina. Je o něco viskóznější a hustší než voda. Kvůli bezpečnosti se destiluje za nízkých teplot a za sníženého tlaku, protože se při zahřívání rozkládá ve výbušné formě.
Zápach
Ostrý nebo ozonovitý zápach.
Chuť
Hořký
Hustota
Pevná látka 1,71 g / cm3
Hustoty jeho vodných roztoků závisí na jejich koncentraci; například při 27% má hustotu 1,10 g / cm3, zatímco na 50%, 1,13 g / cm3
Bod tání
- 0,43 ° C
Bod varu
150,2 ° C Tato hodnota byla získána extrapolací, protože peroxid vodíku se rozkládá při vysokých teplotách.
Rozpustnost ve vodě
Mísitelný ≥ 100 mg / ml při 25 ° C
Rozpustnost
Je rozpustný v etheru a alkoholech, ale nerozpustný v petroletheru. Rozkládá se na vodu a kyslík v mnoha organických rozpouštědlech.
Rozdělovací koeficient oktanol / voda
Log P = - 0,43
Tlak páry
5 mmHg při 30 ° C.
Disociační konstanta
pKa = 11,72
pH
Roztoky peroxidu vodíku jsou mírně kyselé. Například 35% má pH 4,6; ale koncentrováním na 90% se pH stává méně kyselým: 5.1.
Index lomu (čD)
14061
Viskozita
1,245 cPoise při 20 ° C.
Tepelná kapacita
1267 J / gK (plyn)
2 619 J / gK (kapalina)
Odpařovací teplo
1519 J / gK
Stabilita
Stabilní za doporučených podmínek. Dále se stabilizuje přidáním acetanilidu a solí cínu.
Koroze
Korozívní
Rozklad
Rozkládá se při vystavení světlu nebo v přítomnosti oxidačních a redukčních látek. Rozkládá se také na topení. Když se rozkládá, uvolňuje vodu a kyslík a je zvýhodněn zvýšením pH a teploty a také přítomností enzymu katalázy..
Povrchové napětí
80,4 dynů / cm při 20 ° C
Reaktivita
HdvaNEBOdva Působí jako oxidační činidlo v kyselých roztocích železného železa (Fedva+) na železité železo (F3+); také oxiduje siřičitanový iont (SO3dva-) na síranový iont (SO4dva-).
Může také působit jako redukční činidlo v přítomnosti bazických roztoků, redukujících chlornan sodný (NaOCl) a manganistan draselný (KMnO4) s uvolňováním kyslíku.
Aplikace
Bělení
Peroxid vodíku se používá v papírenském průmyslu při bělení buničiny a papíru, které spotřebovává většinu své roční produkce.
Dezinfekční prostředek
Peroxid vodíku je mírné antiseptikum, které zabraňuje infekci malých ran, škrábanců a popálenin. Používá se také jako ústní voda a ke zmírnění mírného podráždění úst kvůli přítomnosti vředů nebo zánětu dásní..
Používá se také k dezinfekci povrchů, vnitřních částí chladniček, vody a v boji proti nadměrnému množení bakterií ve vodních systémech a chladicích věžích. Peroxid vodíku uvolňuje volné kyslíkové radikály, které štěpí znečišťující látky.
Čisticí prostředek
Peroxid vodíku se používá při výrobě detergentů pro bělení prádla, včetně peruhličitanu sodného. Tato sloučenina je komplex uhličitanu sodného a peroxidu vodíku, který se po rozpuštění ve vodě rozdělí na své složky.
Kosmetická aplikace
Zředěný peroxid vodíku se používá k bělení vlasů před barvením. Používá se také k bělení zubů a také jako součást domácí zubní pasty.
Pohonná látka
Peroxid vodíku se používá jako monopropellant nebo oxidační složka bipropolentní rakety. Rozkládá uvolňování kyslíku a vody, což je vlastnost, která umožňovala jeho použití jako hnacího plynu.
Je čerpána do reakční buňky s přítomností katalyzátoru, který urychluje uvedený rozklad. Během toho se vytváří vodní pára o vysoké teplotě.
Když je pára vytlačena mezerou, vytváří impuls. Ponorka V-80, postavená v roce 1940, používala ve svých turbínách kyslík generovaný z peroxidu vodíku; zavolal Walterův turbínový systém.
Získávání
Zpočátku se peroxid vodíku průmyslově získával hydrolýzou persíranu amonného, [(NH4)dvaSdvaNEBO8] nebo elektrolýza hydrogensíranu amonného, NH4HSO4.
Peroxid vodíku se v současné době průmyslově získává použitím antrachinonu. Proces probíhá ve čtyřech stupních: hydrogenace, filtrace, oxidace, extrakce a čištění..
Hydrogenace
Alkylantrochinon se hydrogenuje průchodem plynného vodíku přes hydrogenátor naplněný oxidem hlinitým a malým množstvím katalyzátoru (palladia). Teplota se za stálého míchání udržuje na 45 ° C.
Alkyldrochinon se převádí na alkylanthrahydrochinon a tetrahydroalkylanthrahydrochinon, přičemž druhý je vybrán z důvodu většího pohodlí pro následující postupy.
Filtrace
Roztok obsahující hydrogenovaný antrachinon se filtruje, aby se odstranily stopy katalyzátoru, který může obsahovat..
Oxidace
Filtrovaný roztok se oxiduje průchodem vzduchu za vzniku peroxidu vodíku o nízké čistotě..
Extrakce a čištění
Roztok s peroxidem vodíku prochází extrakční kolonou kapalina-kapalina. Voda protéká kolonou, zatímco se roztokem s peroxidem vodíku čerpá.
Voda dosáhne na dno extraktoru s koncentrací peroxidu vodíku mezi 25 a 35% hmotn./hmotn. Poté se čistí vakuovou destilací na koncentraci peroxidu vodíku 30%. Nakonec se stabilizuje a uloží.
Rizika
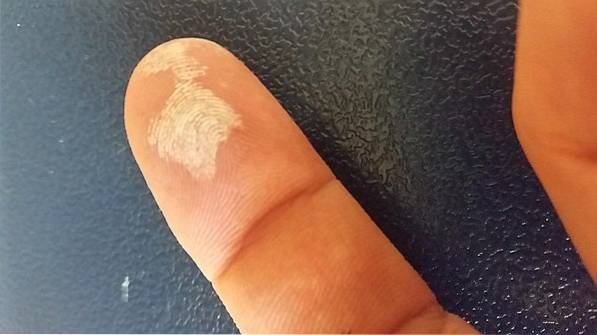
Peroxid vodíku je žíravina, takže při kontaktu s pokožkou způsobuje silné podráždění a také dočasné bělení (obrázek výše). Může také způsobit poškození očí, svědění, vyrážku, zarudnutí a puchýře..
Vdechování způsobuje podráždění nosu, krku a plic. Opakovaná expozice může mezitím způsobit bronchitidu, kašel, hlen a dušnost. A jako by to nestačilo, také to generuje bolesti hlavy, závratě, nevolnost a zvracení.
Silné vystavení peroxidu vodíku může způsobit hromadění tekutin v plicích, známé jako plicní edém - vážný stav vyžadující okamžitou lékařskou pomoc..
Správa bezpečnosti a ochrany zdraví při práci (OSHA) stanovila maximální povolený obsah peroxidu vodíku 1 ppm v pracovním prostředí za 8 hodinovou směnu. Jelikož se však jedná o mutagenní sloučeninu, měla by být expozice omezena na minimum..
Reference
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Wikipedia. (2019). Peroxid vodíku. Obnoveno z: en.wikipedia.org
- William R. Busing a Henri A. Levy. (2004). Krystalová a molekulární struktura peroxidu vodíku: studie neutronů - difrakce. doi.org/10.1063/1.1696379
- Národní centrum pro biotechnologické informace. (2019). Peroxid vodíku. Databáze PubChem. CID = 784. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Redaktoři Encyclopaedia Britannica. (27. listopadu 2018). Peroxid vodíku. Encyklopedie Britannica. Obnoveno z: britannica.com
- Ministerstvo zdravotnictví v New Jersey. (2016). Peroxid vodíku. [PDF]. Obnoveno z: nj.gov
- Mathews, C. K., Van Holde, K. E., Ahern, K. G. (2002). Biochemie. Třetí edice. Vydavatel Pearson Addison Wesley
- Web MD. (2019). Peroxid vodíku. Obnoveno z: webmd.com



Zatím žádné komentáře