
Vlastnosti, funkce, histologie Peyerových náplastí

The Peyerovy náplasti Jsou to anatomické oblasti umístěné pod sliznicí gastrointestinálního traktu, konkrétně v lamina propria tenkého střeva. Jsou to místa agregace velkého počtu lymfocytů a dalších pomocných buněk, proto představují součást imunitního systému sliznic..
Stejně jako mandle v hltanu a lymfoidní folikuly v submukóze slepého střeva připomínají Peyerovy skvrny svou strukturou a funkcí lymfatické uzliny, s tím rozdílem, že první nejsou zapouzdřeny jako uzliny..
Je důležité si uvědomit, že imunitní odpověď (obranný systém těla proti vnějším „útočníkům“) je zprostředkována různými typy buněk, přičemž nejdůležitější jsou lymfocyty, protože díky své schopnosti rozpoznávat antigeny jsou odpovědné za spuštění specifických imunitní odpovědi.
Peyerovy náplasti popsal v roce 1645 italský Marco Aurelio Severino jako „lymfoidní folikuly“, ale až v roce 1677 byl termín „Peyerovy náplasti“ vytvořen na počest švýcarského patologa Johanna Conrada Peyera, který o nich podrobně popsal.
Jeho funkce však byla stanovena o mnoho let později, když si v roce 1922 všiml Kenzaburo Kumagai schopnosti „absorbovat“ patogenní a cizí buňky z epitelu do epiteliální „kupoly“ Peyerových náplastí..
Rejstřík článků
- 1 Funkce
- 2 funkce
- 2.1 Při navozování „orální“ imunitní tolerance
- 3 Histologie
- 3.1 - Struktura
- 3.2 - Vaskulatura Peyerových náplastí
- 4 Související nemoci
- 4.1 Crohnova choroba
- 4.2 Nemoc štěpu proti hostiteli (GvHD)
- 5 Reference
Vlastnosti
Peyerovy náplasti patří k tzv. „Střevní lymfatické tkáni“ neboli GALT. Gut-NAspojené Lymphoid Tproblém "), který se skládá z lymfoidních folikulů distribuovaných v gastrointestinálním traktu.
Tato lymfatická tkáň spojená se střevem představuje jeden z největších lymfoidních orgánů v těle, protože obsahuje téměř 70% imunitních buněk nebo „imunocytů“.
Lymfoidní folikul je agregát nebo soubor lymfoidních buněk, který nemá definovanou strukturu nebo konkrétní organizaci..
Obvykle se v lymfatické tkáni spojené se střevy tyto folikuly izolují od sebe navzájem, ale folikuly v ileu (poslední část tenkého střeva) se shlukují a vytvářejí Peyerovy skvrny..
V lidském tenkém střevě mají Peyerovy skvrny „oválný“ tvar a jsou nepravidelně rozloženy. Cornes v roce 1965 zjistil, že počet plaků během lidského vývoje vrcholí mezi 15 a 25 lety a následně s věkem klesá..
Jiní vědci se ujistili, že oblast obsazená Peyerovými skvrnami v ileu má maximální bod během třetího desetiletí života a že největší část z nich je soustředěna v posledních 25 cm ileum..
Stejně jako mnoho jiných tkání lidského těla závisí organogeneze Peyerových náplastí do značné míry na účasti specifických cytokinů, které zprostředkovávají diferenciaci a uspořádání těchto anatomických oblastí..
Funkce
Hlavní funkcí Peyerových náplastí jako součásti imunitního systému střevní sliznice je ochrana „skořápky“ střev před invazí potenciálně patogenních mikroorganismů..
Některé z buněk lymfoidních folikulů přítomných v této „oblasti“ střeva jsou odpovědné za rozlišení mezi patogenními mikroorganismy a „komenzalisty“ (kteří patří k původní mikroflóře), protože tyto folikuly interagují přímo s intestinálním epitelem.
Při navození „orální“ imunitní tolerance
Peyerovy náplasti se účastní „příjmu“ cizích nebo patogenních buněk, bylo však prokázáno, že buňky patřící do této oblasti jsou také schopné rozlišovat mezi určitými antigeny a mezi nepatogenními bakteriemi spojenými s intestinálním traktem..
Tento proces rozpoznávání nepatogenních látek je známý jako „orální tolerance“ a jedná se o aktivní proces, který vede k tvorbě specifických T lymfocytů, které jsou schopné zabránit spuštění zbytečné imunitní odpovědi..
Orální tolerance je také definována jako antigenově specifická eliminace humorálních a buněčných imunitních odpovědí na antigeny, které se dostávají do těla orální cestou, což je zvláště užitečné pro ochranu střevní sliznice před nepříznivými zánětlivými imunitními odpověďmi..
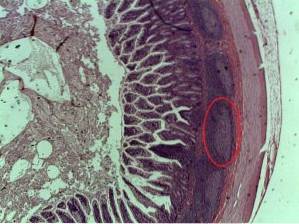
Histologie
Peyerovy náplasti jsou součástí lamina propria tenkého střeva. Lamina propria se skládá z volné pojivové tkáně, která je zároveň součástí tzv. „Jádra“ střevních klků.
V lamina propria se nacházejí různé typy plazmatických buněk, lymfocytů, leukocytů, fibroblastů, žírných buněk a dalších a Peyerovy náplasti jsou částí lamina propria, kde se nacházejí trvalé sady lymfoidních uzlin nebo folikulů..
- Struktura
Peyerovy patche jsou architektonicky rozlišeny do tří hlavních domén známých jako:
1- Folikulární oblast
2- Interfolikulární oblast a
3- Epitel spojený s lymfoidními folikuly.
Folikulární a interfolikulární oblast
Tato oblast se skládá z lymfoidních uzlů nebo folikulů charakteristických pro Peyerovy náplasti, které jsou složeny z B buněk (B lymfocytů) obklopených méně kompaktní (volnou) částí T buněk (T lymfocytů) a mnoha folikulárních dendritických buněk nebo „buněk prezentujících antigen“ (APC) NAntigen Pnesnášet Cell).
Část, kde se nacházejí lymfocyty nebo replikativní B buňky, dendritické buňky a jiný typ buňky, makrofágy, se nazývá „zárodečné centrum“. Každý lymfoidní folikul je zase obklopen takzvanou „korunou“ nebo „subepiteliální kopulí“..
Subepiteliální kopule má také směs lymfoidních buněk (B a T lymfocytů), folikulárních dendritických buněk a makrofágů, což představuje interfolikulární oblast..
Bylo prokázáno, že v lymfoidních folikulech dospělých myší je podíl B buněk ve vnitřní oblasti těchto struktur více či méně 50 nebo 70%, zatímco T buňky představují pouze 10 až 30%.
Některé výzkumy také naznačují přítomnost jiného specializovaného typu buněk známých jako eosinofily, jehož podíl se zvyšuje po expozici orálním alergenům..
Epitel spojený s lymfoidními folikuly
Ileum je lemováno jednoduchým epitelem (jedna vrstva buněk) uspořádaným válcovitě. Avšak v oblastech sousedících s lymfoidními folikuly Peyerových náplastí existuje velké množství dlaždicových buněk známých jako M buňky, mikroskládací buňky nebo specializované membránové buňky..
Zdá se, že hlavní funkcí M buněk sousedících s těmito folikuly je zachytit antigeny a nasměrovat je nebo přenést do makrofágů, které jsou také spojeny s Peyerovými náplastmi..
M buňky nemají mikroklky a aktivně vedou pinocytózu k dosažení transportu z lumen tenkého střeva do subepiteliálních tkání..
Imunitní systém spojený se sliznicí je spojen se zbytkem imunitního systému těla díky aktivační a migrační kapacitě T lymfocytů z Peyerových náplastí, které mohou dosáhnout systémového oběhu za účelem výkonu svých imunitních funkcí..
Další charakteristické rysy
Na rozdíl od epitelu sliznice střevních klků má epitel spojený s lymfoidními folikuly nízkou produkci hlenu, navíc jsou špatně exprimovány trávicí enzymy a glykosylační vzorce prvků spojených s glykokalyxem jsou odlišné.
- Peyerovy vaskulatury
Na rozdíl od jiných lymfoidních tkání, jako jsou lymfatické uzliny, Peyerovy náplasti nemají aferentní lymfatické cévy, které nesou lymfy „uvnitř“. Mají však eferentní drenáž nebo eferentní lymfatické cévy, schopné transportovat lymfy z lymfoidních folikulů.
Buňky uvnitř plaků jsou dodávány arterioly nebo malými krevními cévami, které jsou schopné tvořit kapilární lůžko odváděné vysokými endotelovými žilkami..
Související nemoci
Vzhledem k důležité roli, kterou Peyerovy náplasti hrají v lidském těle, existuje velké množství souvisejících patologií, mezi nimiž lze zmínit následující:
Crohnova nemoc
Jedná se o zánětlivou patologii charakterizovanou opakujícím se zánětem zažívacího traktu. Zapojení Peyerových náplastí do tohoto onemocnění je způsobeno skutečností, že typické léze způsobují spouštění adaptivních nebo vrozených imunitních odpovědí na bakteriální flóru..
Navíc se zdá, že Crohnova choroba postihuje zejména distální ileum, právě tam, kde je velké množství Peyerových náplastí..
Choroba štěpu proti hostiteli nebo „Nemoc štěpu proti hostiteli “ (GvHD)
Tento stav je evidentní jako „bitva“ mezi štěpy nebo transplantacemi od jednoho pacienta k druhému geneticky nekompatibilní..
Předpokládá se, že interakce mezi bakteriální flórou a epitelovou imunitní odpovědí přispívá k vyvolání zánětlivých signálů, které přispívají ke stimulaci T buněk odvozených od dárce zprostředkovaných hostitelskými buňkami prezentujícími antigen..
Účast Peyerových náplastí na tomto procesu uznala Murai a kol., Kteří prokázali, že tyto struktury jsou anatomickým místem, kde dochází k infiltraci dárcovských T buněk a kde se tvoří „antihostitelské“ cytotoxické T buňky..
Reference
- Bonnardel, J., DaSilva, C., Henri, S., Tamoutounour, S., Chasson, L., Montañana-Sanchis, F.,… Lelouard, H. (2015). Vrozené a adaptivní imunitní funkce buněk Peyer's Patch odvozených od monocytů. Zprávy buněk, jedenáct(5), 770-784.
- Collins, K. J., Cashman, S., Morgan, J., & Sullivan, G. C. O. (2012). Gastrointestinální imunitní systém: Rozpoznávání mikrobů ve střevě. Annals of Gastroenterology & Hepatology, 3(1), 23-37.
- Da Silva, C., Wagner, C., Bonnardel, J., Gorvel, J. P., & Lelouard, H. (2017). Mononukleární fagocytový systém Peyerovy náplasti v ustáleném stavu a během infekce. Hranice v imunologii.
- Gartner, L., & Hiatt, J. (2002). Text atlasu histologie (2. vyd.). México D.F .: McGraw-Hill Interamericana Editores.
- Jung, C., Hugot, J., & Barreau, F. (2010). Peyer's Patches: The Immune Sensors of the Intine. International Journal of Inflammation, 1-12.
- Kagnoff, M., a Campbell, S. (1974). Funkční charakteristiky lymfatických buněk Peyer's Patch. I. Indukce humorálních protilátek a buněčně zprostředkované reakce štěpu. The Journal of Experimental Medicine, 139, 398-406.
- Keren, D. F., Holt, P. S., Collins, H. H., Gemski, P., Formal, S. B., Keren, D. F., ... Formal, S. B. (1978). Role Peyerových náplastí v místní imunitní reakci králičího ilea na živé bakterie. The Journal of Immunology, 120(6), 1892-1896.
- Kindt, T., Goldsby, R. a Osborne, B. (2007). Kubyho imunologie (6. vydání). México D.F .: McGraw-Hill Interamericana de España.
- Kogan, A. N., & von Andrian, U. H. (2008). Obchodování s lymfocyty. v Mikrocirkulace (str. 449-482).
- Mayrhofer, G. (1997). Peyerova náplast organogeneze - pravidlo cytokinů, ok? Střevo, 41(5), 707-709.
- Mishra, A., Hogan, S. P., Brandt, E. B. a Rothenberg, M. E. (2000). Peyerova náplast eosinofily: identifikace, charakterizace a regulace expozicí alergenům na sliznici, interleukin-5 a eotaxin. Krev, 96(4), 1538-1545.



Zatím žádné komentáře