
Polarita (chemie) polárních molekul a příklady
The chemická polarita je to vlastnost, která se vyznačuje přítomností výrazného heterogenního rozložení hustot elektronů v molekule. Ve své struktuře proto existují záporně nabité oblasti (δ-) a další kladně nabité oblasti (δ +), které generují dipólový moment.
Vazebný dipólový moment (µ) je způsob, jak vyjádřit polaritu molekuly. Obvykle je reprezentován jako vektor, jehož počátek je v náboji (+) a jeho konec je umístěn v náboji (-), ačkoli někteří chemici jej představují nepřímo.
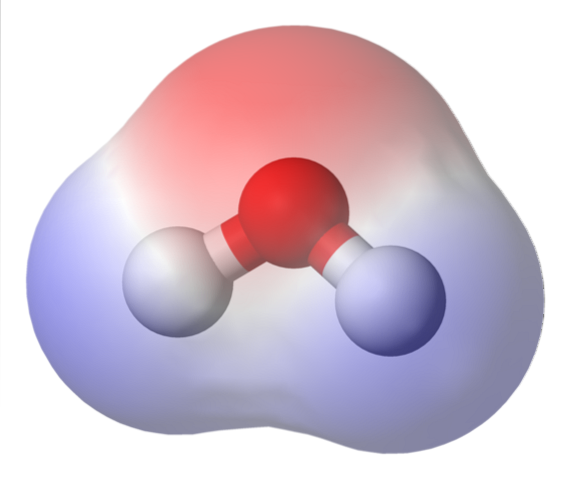
Horní obrázek ukazuje mapu elektrostatického potenciálu pro vodu, HdvaO. načervenalá oblast (atom kyslíku) odpovídá oblasti s nejvyšší hustotou elektronů a je také vidět, že vyniká nad modrými oblastmi (atomy vodíku).
Protože distribuce této elektronové hustoty je heterogenní, říká se, že existuje kladný a záporný pól. Proto se mluví o chemické „polaritě“ a dipólovém momentu.
Rejstřík článků
- 1 Dipólový moment
- 1.1 Asymetrie v molekule vody
- 2 Polární molekuly
- 3 příklady
- 3.1 SO2
- 3,2 CHC13
- 3,3 HF
- 3,4 NH3
- 3.5 Makromolekuly s heteroatomy
- 4 Odkazy
Dipólový moment
Dipólový moment µ je definován následující rovnicí:
u = 5d
Kde δ je elektrický náboj každého pólu, kladný (+ δ) nebo záporný (-δ), a d je vzdálenost mezi nimi.
Dipólový moment je obvykle vyjádřen v debye, reprezentovaném symbolem D. Jeden coulomb · metr se rovná 2,998 · 1029 D.
Hodnota dipólového momentu vazby mezi dvěma různými atomy je ve vztahu k rozdílu v elektronegativitách atomů, které tvoří vazbu..
Aby byla molekula polární, nestačí mít ve své struktuře polární vazby, ale musí mít také asymetrickou geometrii; takovým způsobem, že brání tomu, aby dipólové momenty rušily navzájem vektory.
Asymetrie v molekule vody
Molekula vody má dvě O-H vazby. Geometrie molekuly je úhlová, to znamená ve tvaru písmene „V“; takže dipólové momenty vazeb se navzájem nevyrušují, ale spíše se vytváří jejich součet směřující k atomu kyslíku.
Mapa elektrostatického potenciálu pro HdvaNebo to přemýšlejte.
Pokud je pozorována úhlová molekula H-O-H, může vyvstat následující otázka: je to opravdu asymetrické? Pokud je imaginární osa protažena atomem kyslíku, molekula se rozdělí na dvě stejné poloviny: H-O | O-H.
Není tomu ale tak, pokud je imaginární osa vodorovná. Když tato osa nyní rozdělí molekulu znovu na dvě poloviny, budeme mít atom kyslíku na jedné straně a dva atomy vodíku na druhé straně..
Z tohoto důvodu je zřejmá symetrie HdvaNebo přestane existovat, a je proto považována za asymetrickou molekulu.
Polární molekuly
Polární molekuly musí splňovat řadu charakteristik, například:
-Distribuce elektrických nábojů v molekulární struktuře je asymetrická.
-Obvykle jsou rozpustné ve vodě. Je to proto, že polární molekuly mohou interagovat pomocí dipól-dipólových sil, kde voda je charakterizována tím, že má velký dipólový moment.
Kromě toho je jeho dielektrická konstanta velmi vysoká (78,5), což mu umožňuje udržovat oddělené elektrické náboje a zvyšovat tak jeho rozpustnost..
-Polární molekuly mají obecně vysoké teploty varu a teploty tání.
Tyto síly jsou tvořeny interakcí dipól-dipól, londýnskými disperzními silami a tvorbou vodíkových vazeb..
-Díky elektrickému náboji mohou polární molekuly vést elektřinu.
Příklady
SWdva
Oxid siřičitý (SOdva). Kyslík má elektronegativitu 3,44, zatímco elektronegativita síry je 2,58. Kyslík je tedy více elektronegativní než síra. Existují dvě vazby S = O, přičemž O má náboj δ- a náboj S a δ+.
Protože se jedná o úhlovou molekulu s S na vrcholu, jsou dva dipólové momenty orientovány stejným směrem; a proto se sčítají a tvoří molekulu SOdva být polární.
CHCI3
Chloroform (HCCI3). Existuje jedna vazba C-H a tři vazby C-Cl.
Elektronegativita C je 2,55 a elektronegativita H je 2,2. Uhlík je tedy více elektronegativní než vodík; a proto bude dipólový moment orientován od H (δ +) směrem k C (δ-): Cδ--Hδ+.
V případě vazeb C-Cl má C elektronegativitu 2,55, zatímco Cl má elektronegativitu 3,16. Dipólový vektor nebo dipólový moment je orientován od C k Cl ve třech C vazbách δ+-Cl δ-.
Protože kolem atomu vodíku je oblast chudá na elektrony a oblast bohatá na elektrony složená ze tří atomů chloru, CHCl3 je považována za polární molekulu.
HF
Fluorovodík má pouze jednu vazbu H-F. Elektronegativita H je 2,22 a elektronegativita F je 3,98. Proto fluor končí s nejvyšší hustotou elektronů a vazbu mezi oběma atomy lze nejlépe popsat jako: Hδ+-Fδ-.
NH3
Amoniak (NH3) má tři N-H vazby. Elektronegativita N je 3,06 a elektronegativita H je 2,22. Ve všech třech vazbách je elektronová hustota orientována na dusík, přičemž je ještě vyšší díky přítomnosti dvojice volných elektronů.
Molekula NH3 je čtyřboká, přičemž atom N zabírá vrchol. Tři dipólové momenty, odpovídající N-H vazbám, jsou orientovány stejným směrem. V nich se δ- nachází v N a δ + v H. Vazby jsou tedy: Nδ--Hδ+.
Tyto dipólové momenty, asymetrie molekuly a volný pár elektronů na dusíku činí z amoniaku vysoce polární molekulu..
Makromolekuly s heteroatomy
Pokud jsou molekuly velmi velké, již není jisté, že je klasifikujeme jako nepolární nebo polární. Je to proto, že mohou existovat části jeho struktury s apolárními (hydrofobními) i polárními (hydrofilními) charakteristikami..
Tyto typy sloučenin jsou známé jako amfifily nebo amfipatika. Protože apolární část může být považována za elektronově chudou s ohledem na polární část, je ve struktuře přítomna polarita a amfifilní sloučeniny jsou považovány za polární sloučeniny..
U makromolekuly s heteroatomy lze obecně předpokládat, že má dipólové momenty, a tedy chemickou polaritu..
Heteroatomy jsou chápány jako ty, které se liší od těch, které tvoří kostru struktury. Například uhlíková kostra je biologicky nejdůležitější ze všech a atom, s nímž uhlík vytváří vazbu (kromě vodíku), se nazývá heteroatom..
Reference
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Prof. Krishnan. (2007). Polární a nepolární sloučeniny. St. Louis Community College. Obnoveno z: users.stlcc.edu
- Murmson, Serm. (14. března 2018). Jak vysvětlit polaritu. Vědění. Obnoveno z: sciencing.com
- Helmenstine, Anne Marie, Ph.D. (5. prosince 2018). Definice a příklady polárních dluhopisů (Polar Covalent Bond). Obnoveno z: thoughtco.com
- Wikipedia. (2019). Chemická polarita. Obnoveno z: en.wikipedia.org
- Quimitube. (2012). Kovalentní vazba: polarita vazby a polarita molekul. Obnoveno z: quimitube.com


Zatím žádné komentáře