
Potenciometr (pH metr) K čemu slouží a jak funguje

A potenciometr je zařízení používané k měření rozdílu potenciálů mezi pracovní a referenční elektrodou, když jsou obě ponořeny do roztoku, u kterého je žádoucí určit jeho kyselost nebo zásaditost, což vyjadřuje jako pH.
Tímto způsobem potenciometrie označuje analytickou metodu použitou ke stanovení koncentrace iontů H.+ v látce, která je v roztoku, pomocí potenciometru a dvou výše zmíněných elektrod.

V případě referenční elektrody má na rozdíl od pracovní elektrody známý, konstantní a stabilní potenciál. Potenciál, který se vyvíjí v této poslední elektrodě, se mění úměrně s koncentrací iontů H+ které jsou v řešení.
Tento potenciál je také do značné míry ovlivněn teplotou, při které se měření provádí..
Rejstřík článků
- 1 K čemu to je?
- 2 Jak to funguje?
- 2.1 Elektrody
- 2.2 Kalibrace potenciometru
- 3 Odkazy
K čemu to je?
V průmyslovém odvětví se provádí velké množství procesů - jako je výroba léčiv, zpracování potravin a čištění vody -, které jsou vysoce citlivé na kolísání úrovní pH. Z tohoto důvodu je jeho správné měření tak důležité.
Jak již bylo zmíněno dříve, pH je parametr používaný k měření kyselosti nebo zásaditosti roztoku, který je ve vodné fázi, analýzou koncentrace iontů H.+ v řešení. Poté se hodnota pH vypočítá podle následující rovnice:
pH = -log [H+]
Potenciometr se tedy používá k měření pH látky v roztoku..
Když je potenciometr připojen ke dvěma elektrodám ponořeným do analyzovaného roztoku, detekuje potenciální rozdíl mezi pracovní elektrodou a referenční elektrodou, zesiluje tento signál a převádí jej na hodnotu pH pomocí výše popsané rovnice..
Jak to funguje?
Činnost potenciometru je založena na mechanismu elektrochemického článku, kde jsou zapojeny ionty H+ při chemické reakci buňky určit koncentraci těchto iontů v roztoku a tímto způsobem získat pH stejné.
Pokud je žádoucí měřit pH roztoku potenciometrií, použije se potenciometr a elektroda; první je zařízení, které určuje pH, zatímco druhé je založeno na kombinaci referenční elektrody a měřicí elektrody, která je citlivá na analyty.
V tomto smyslu je vytvořen obvod, kterým prochází elektrický proud mezi elektrodami a roztokem, kde při ponoření do uvedeného řešení plní funkci baterie..
Tímto způsobem je potenciometr navržen tak, aby generoval napětí rovné nule (v jednotkách milivoltů), když má pH rovné sedmi; to je neutrální.
Podobně, když je registrován nárůst potenciálních hodnot (s kladnými čísly), znamená to, že existují nižší hodnoty pH, a když je pozorován pokles - tedy růst směrem k záporným číslům - mluvíme o vyšších hodnotách..
Elektrody
Měřicí (nebo pracovní) elektroda se skládá ze zařízení, ve kterém probíhá studovaná reakce (oxidace nebo redukce).
I když existuje mnoho druhů, obvykle se jedná o sklo, které se skládá z velmi tenké skleněné membrány, která má propustnost pro ionty H.+ prostředí, ve kterém je.
Umístěním tohoto roztoku do roztoku, jehož pH se liší od pH přítomného v článku, je generován potenciální rozdíl mezi dvěma stranami membrány a tento rozdíl lze zaznamenat pomocí referenční elektrody..
Na druhé straně je referenční elektroda zařízení, které má vlastnosti stabilního potenciálu a se známou hodnotou, které se obvykle používá jako anoda v elektrochemickém článku..
Příkladem tohoto typu elektrody je ten, který je vyroben ze stříbrného drátu, který je potažen chloridem stříbrným a ponořen do zředěného roztoku kyseliny chlorovodíkové, nebo referenční elektroda nasycená kalomelem, jako je ta, která je znázorněna na obrázku níže..
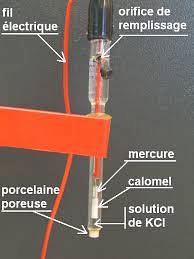
Potenciometr tedy určuje potenciální rozdíl, který se generuje mezi elektrodami, i když pouze potenciál pracovní elektrody závisí na koncentracích iontových druhů..
Kalibrace potenciometru
Kalibrace potenciometru musí být prováděna pomocí známých pufrovacích roztoků (nazývaných také pufry nebo pufrovací roztoky), které se skládají ze systémů s prakticky neměnným pH, které obsahují slabou látku a její konjugované druhy..
Každý pufr má specifické pH, které může být kyselé (pH<7), básico (pH>7) nebo neutrální (pH = 7) a lze je zakoupit komerčně již standardizované nebo připravené v laboratoři s certifikovanými činidly a za použití zavedených a ověřených postupů..
Protože potenciometry měří hodnotu pH v rozsahu, který je považován za široký, je třeba vědět, zda má analyt hodnotu pH vyšší nebo nižší než sedm, aby mohla pokračovat ve správné kalibraci..
U vzorků, u nichž se očekává, že pH bude zásadité, by tedy mělo být kalibrováno pufrovacím roztokem s pH rovným sedmi a dalším s vyšším pH (obvykle se používá jeden z pH deset)..
Na druhé straně se u vzorků s očekávaným kyselým pH kalibruje pufrovacím roztokem s pH rovným sedmi a dalším s nižším pH (obvykle se používá pH čtyři)..
Nakonec musí být rekalibrace tohoto měřicího přístroje provedena před a po každém použití, přičemž se zaznamenají jeho výsledky, včetně data a času, kdy byly provedeny, a charakteristik pufrových roztoků použitých k jeho ovládání..
Reference
- Wikipedia. (s.f.). pH metr. Získané z es.wikipedia.org
- Chang, R. (2007). Chemistry, deváté vydání. (McGraw-Hill).
- Westcott, C. (2012). Měření Ph. Získané z books.google.co.ve
- Nielsen, C. (1996). Správa analytické laboratoře: prostá a jednoduchá. Získané z books.google.co.ve
- Kenkel, J. (2010). Analytical Chemistry for Technicians, třetí vydání. Získané z books.google.co.ve
- Cable, M. (2005). Kalibrace: Příručka technika. Získané z books.google.co.ve


Zatím žádné komentáře