
Aufbauův princip a vysvětlení, příklady
The Aufbauův princip Skládá se z užitečného průvodce, který teoreticky předpovídá elektronickou konfiguraci prvku. Slovo aufbau odkazuje na německé sloveso „stavět“. Pravidla diktovaná tímto principem mají „pomoci vybudovat atom“.
Když mluvíme o hypotetické atomové konstrukci, vztahuje se to výlučně na elektrony, které zase jdou ruku v ruce s rostoucím počtem protonů. Protony definují atomové číslo Z chemického prvku a ke každému přidanému do jádra se přidá elektron, který kompenzuje toto zvýšení kladného náboje..
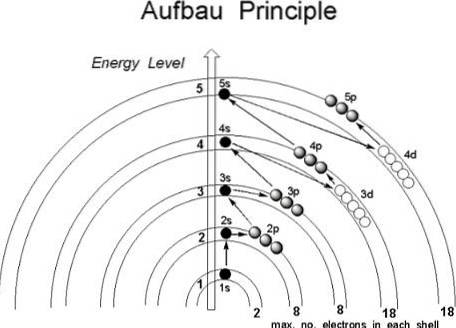
Ačkoli se zdá, že protony nenásledují zavedený řád, aby se připojily k jádru atomu, elektrony dodržují řadu podmínek, a to takovým způsobem, že nejprve obsadí oblasti atomu s nižší energií, konkrétně ty, kde pravděpodobnost jejich nalezení ve vesmíru je větší: orbitaly.
Princip Aufbau spolu s dalšími pravidly elektronického plnění (Pauliho vylučovací princip a Hundovo pravidlo) pomáhá stanovit pořadí, v němž by měly být elektrony přidávány do elektronového mraku; tímto způsobem je možné přiřadit správnou elektronickou konfiguraci určitého chemického prvku.
Rejstřík článků
- 1 Koncept a vysvětlení
- 1.1 Vrstvy a podvrstvy
- 1.2 Pauliho princip vyloučení a Hundovo pravidlo
- 2 Příklady
- 2.1 Uhlík
- 2.2 Kyslík
- 2.3 Vápník
- 3 Omezení principu Aufbau
- 4 Odkazy
Koncept a vysvětlení
Pokud by byl atom považován za cibuli, našel by se v ní konečný počet vrstev, určený hlavním kvantovým číslem n.
Dále jsou v nich podsvětí, jejichž tvary závisí na kvantových číslech azimutální l a magnetické m.
Orbitály jsou identifikovány prvními třemi kvantovými čísly, zatímco čtvrté, rotace s, končí, což naznačuje, ve které oběžné dráze bude elektron umístěn. Právě v těchto oblastech atomu se elektrony otáčejí, od nejvnitřnějších po nejvzdálenější vrstvy: valenční vrstva, nejúčinnější ze všech..
V tomto případě, v jakém pořadí by měly elektrony zaplnit orbitaly? Podle principu Aufbau by měly být přiřazeny na základě rostoucí hodnoty (n + l).
Podobně musí uvnitř elektronů (n + l) zaujímat elektrony subshell s nejnižší energetickou hodnotou; jinými slovy, zaujímají nejnižší hodnotu n.
V souladu s těmito konstrukčními pravidly vyvinul Madelung vizuální metodu, která spočívá v kreslení diagonálních šipek, které pomáhají budovat elektronickou konfiguraci atomu. V některých vzdělávacích sférách je tato metoda známá také jako dešťová metoda..
Vrstvy a podvrstvy
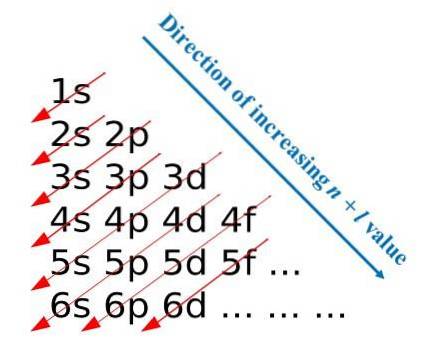
První obrázek ilustruje grafickou metodu pro získání elektronových konfigurací, zatímco druhý obrázek je příslušná Madelungova metoda. Nejenergetičtější vrstvy jsou umístěny nahoře a nejméně energetické jsou ve směru dolů..
Zleva doprava jsou podvrstvy s, p, d a f jejich odpovídajících hlavních energetických úrovní „tranzitovány“. Jak vypočítat hodnotu (n + l) pro každý krok označený úhlopříčnými šipkami? Například pro orbitál 1 s se tento výpočet rovná (1 + 0 = 1), pro orbitál 2 s (2 + 0 = 2) a pro orbitál 3 p (3 + 1 = 4).
Výsledkem těchto výpočtů je konstrukce obrazu. Pokud tedy není po ruce, jednoduše určete (n + l) pro každý orbitál a začněte plnit orbitaly elektrony od té s nejnižší hodnotou (n + l) po tu s maximální hodnotou.
Použití metody Madelung však značně usnadňuje konstrukci elektronové konfigurace a činí z ní zábavnou aktivitu pro ty, kteří se učí periodickou tabulku..
Pauliho princip vyloučení a Hundova vláda
Madelungova metoda neindikuje orbitaly dílčích skořápek. Když je vezmeme v úvahu, Pauliho vylučovací princip uvádí, že žádný elektron nemůže mít stejná kvantová čísla jako jiný; nebo co je stejné, dvojice elektronů nemůže mít jak pozitivní, tak negativní spiny.
To znamená, že jejich spinová kvantová čísla s nemohou být stejná, a proto se jejich otočení musí spárovat, když zaujímají stejnou orbitální.
Naproti tomu plnění orbitalů musí být provedeno takovým způsobem, aby energeticky zdegenerovaly (Hundovo pravidlo). Toho je dosaženo tím, že všechny elektrony na orbitálech zůstávají nepárované, dokud není bezpodmínečně nutné spárovat pár těchto elektronů (jako u kyslíku).
Příklady
Následující příklady shrnují celý koncept principu Aufbau..
Uhlík
Chcete-li určit jeho elektronickou konfiguraci, musí být nejprve známo atomové číslo Z, a tedy počet elektronů. Uhlík má Z = 6, takže jeho 6 elektronů musí být umístěno na orbitálech pomocí Madelungovy metody:

Šipky odpovídají elektronům. Po naplnění orbitálů 1 s a 2 s, každý se dvěma elektrony, se 2p orbitaly rozdílem přiřadí zbývající dva elektrony. Hundovo pravidlo se tak projevuje: dva zdegenerované orbitaly a jeden prázdný.
Kyslík

Kyslík má Z = 8, takže má na rozdíl od uhlíku dva další elektrony. Jeden z těchto elektronů musí být umístěn na prázdném orbitálu 2p a druhý se musí spárovat, aby vytvořil první pár se šipkou směřující dolů. Zde se tedy projevuje princip vyloučení Pauli.
Vápník
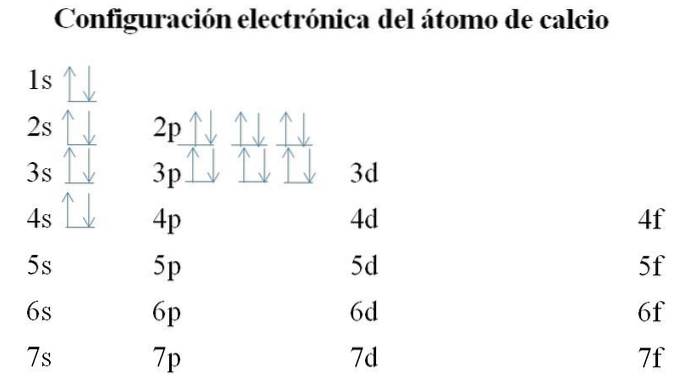
Vápník má 20 elektronů a orbitaly jsou stále vyplňovány stejnou metodou. Pořadí plnění je následující: 1s-2s-2p-3s-3p-4s.
Je možné si povšimnout, že místo toho, aby nejprve vyplnily 3d oběžnou dráhu, elektrony zabírají 4 s. K tomu dochází před uvolněním cesty přechodným kovům, prvkům, které vyplňují vnitřní vrstvu 3d.
Omezení principu Aufbau
Aufbauův princip nedokáže předpovědět elektronické konfigurace mnoha přechodných kovů a prvků vzácných zemin (lanthanidy a aktinidy).
Je to proto, že energetické rozdíly mezi orbitály ns a (n-1) d jsou nízké. Z důvodů podporovaných kvantovou mechanikou mohou elektrony upřednostňovat degeneraci orbitálů (n-1) d za cenu zrušení nebo uvolnění elektronů z orbitalu ns.
Slavným příkladem je případ mědi. Jeho elektronová konfigurace předpovězená Aufbauovým principem je 1 sdva2 sdva2 str63 sdva3p64 sdva3d9, když se experimentálně ukázalo, že je to 1 sdva2 sdva2 str63 sdva3p64 s13d10.
Na prvním je osamělý elektron nepárový na 3d orbitálu, zatímco na druhém jsou všechny elektrony na 3d orbitálech spárovány..
Reference
- Helmenstine, Anne Marie, Ph.D. (15. června 2017). Aufbauova definice principu. Převzato z: thoughtco.com
- N. De Leon. (2001). Princip Aufbau. Převzato z: iun.edu
- Chemistry 301. Aufbau Principle. Převzato z: ch301.cm.utexas.edu
- Hozefa Arsiwala a teacherlookup.com. (1. června 2017). V hloubce: Princip Aufbau s příklady. Převzato z: teacherlookup.com
- Whitten, Davis, Peck a Stanley. Chemie. (8. vydání). CENGAGE Learning, s. 199-203.
- Goodphy. (27. července 2016). Schéma Madelungu. [Postava]. Převzato z: commons.wikimedia.org


Zatím žádné komentáře