
Struktura, vlastnosti a použití deuteria
The deuterium je jeden z izotopových druhů vodíku, který je reprezentován jako D nebo dvaH. Dále se mu říká těžký vodík, protože jeho hmotnost je dvakrát větší než proton. Izotop je druh, který pochází ze stejného chemického prvku, ale jehož hmotnostní číslo se od tohoto liší.
Tento rozdíl je způsoben rozdílem v počtu neutronů, které má. Deuterium je považováno za stabilní izotop a lze jej nalézt v přirozeně se vyskytujících sloučeninách vodíku, i když v poměrně malém podílu (méně než 0,02%).
Vzhledem ke svým vlastnostem, velmi podobným vlastnostem běžného vodíku, může nahradit vodík ve všech reakcích, kterých se účastní, a stát se ekvivalentními látkami..
Z tohoto a dalších důvodů má tento izotop velké množství aplikací v různých oblastech vědy a stává se jedním z nejdůležitějších.
Rejstřík článků
- 1 Struktura
- 1.1 Některá fakta o deuteriu
- 2 Vlastnosti
- 3 použití
- 4 Odkazy
Struktura
Strukturu deuteria tvoří hlavně jádro, které má proton a neutron s atomovou hmotností nebo hmotností přibližně 2 014 g.
Podobně tento izotop vděčí za svůj objev americkému chemikovi Haroldovi C. Ureyovi a jeho spolupracovníkům Ferdinandu Brickweddeovi a Georgovi Murphymu v roce 1931..
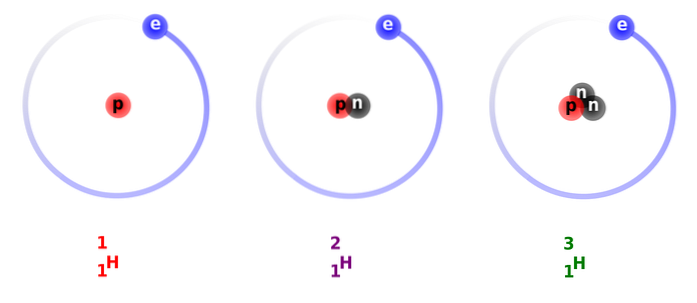
Na výše uvedeném obrázku vidíte srovnání mezi strukturami vodíkových izotopů, které existují ve formě protia (jeho nejhojnějšího izotopu), deuteria a tritia, seřazené zleva doprava.
Příprava deuteria v čistém stavu byla úspěšně provedena poprvé v roce 1933, ale od padesátých let se používá látka v pevné fázi a prokázala stabilitu, která se nazývá deuterid lithný (LiD), aby nahradila deuterium a tritium v velké množství chemických reakcí.
V tomto smyslu byla studována hojnost tohoto izotopu a bylo pozorováno, že jeho podíl ve vodě se může mírně lišit v závislosti na zdroji, ze kterého je vzorek odebrán..
Studie spektroskopie navíc určily existenci tohoto izotopu na jiných planetách v této galaxii..
Některá fakta o deuteriu
Jak bylo uvedeno výše, základní rozdíl mezi vodíkovými izotopy (které jsou jedinými, které byly pojmenovány různými způsoby) spočívá v jejich struktuře, protože počet protonů a neutronů v druhu mu dává jeho chemické vlastnosti.
Na druhou stranu je deuterium existující uvnitř hvězdných těl eliminováno vyšší rychlostí, než jaké vzniklo.
Kromě toho se má za to, že jiné přírodní jevy tvoří jen nepatrné množství, takže její výroba i dnes vzbuzuje zájem..
Podobně řada výzkumů odhalila, že drtivá většina atomů, které byly vytvořeny z tohoto druhu, pochází z Velkého třesku; to je důvod, proč je jeho přítomnost zaznamenána na velkých planetách, jako je Jupiter.
Nejběžnějším způsobem, jak tento druh v přírodě získat, je najít jej v kombinaci s vodíkem ve formě protia, a proto vzbuzuje vztah mezi podílem obou druhů v různých oblastech vědy zájem vědecké komunity. jako je astronomie nebo klimatologie.
Vlastnosti
- Je to izotop postrádající radioaktivní vlastnosti; to znamená, že je v přírodě docela stabilní.
- Může být použit k nahrazení atomu vodíku v chemických reakcích.
- Tento druh vykazuje chování odlišné od běžného vodíku v reakcích biochemické povahy..
- Když jsou dva atomy vodíku nahrazeny vodou, dostaneme D.dvaNebo získání názvu těžké vody.
- Vodík přítomný v oceánu ve formě deuteria existuje v poměru 0,016% ve vztahu k protiu.
- Ve hvězdách má tento izotop tendenci rychle se spojovat, aby vznikl hélium..
- DdvaO je toxický druh, i když jeho chemické vlastnosti jsou velmi podobné jako u H.dva
- Když jsou atomy deuteria vystaveny procesu jaderné fúze při vysokých teplotách, uvolňuje se velké množství energie.
- Fyzikální vlastnosti, jako je bod varu, hustota, odpařovací teplo, trojný bod, mají mimo jiné vyšší velikosti v molekulách deuteria (Ddva) než ve vodíku (Hdva).
- Nejběžnější forma, ve které se nachází, je navázána na atom vodíku a způsobuje deuterid vodíku (HD).
Aplikace
Díky svým vlastnostem se deuterium používá v nejrůznějších aplikacích, ve kterých je zahrnut vodík. Některá z těchto použití jsou popsána níže:
- V oblasti biochemie se používá při izotopovém značení, které spočívá ve „značení“ vzorku vybraným izotopem, aby se sledoval jeho průchod specifickým systémem..
- V jaderných reaktorech, které provádějí fúzní reakce, se používá ke snížení rychlosti pohybu neutronů bez jejich vysoké absorpce, kterou běžný vodík představuje..
- V oblasti nukleární magnetické rezonance (NMR) se k získání vzorků tohoto typu spektroskopie používají rozpouštědla na bázi deuteria bez přítomnosti interferencí, ke kterým dochází při použití hydrogenovaných rozpouštědel..
- V oblasti biologie jsou makromolekuly studovány technikami rozptylu neutronů, kde jsou použity vzorky opatřené deuteriem k významnému snížení šumu v těchto kontrastních vlastnostech..
- V oblasti farmakologie se substituce vodíku za deuterium používá kvůli kinetickému izotopovému účinku, který je generován a umožňuje těmto lékům mít delší poločas.
Reference
- Britannica, E. (s.f.). Deuterium. Obnoveno z britannica.com
- Wikipedia. (s.f.). Deuterium. Citováno z en.wikipedia.org
- Chang, R. (2007). Chemistry, deváté vydání. Mexiko: McGraw-Hill.
- Hyperfyzika. (s.f.). Hojnost deuteria. Obnoveno z hyperphysics.phy-astr.gsu.edu
- ThoughtCo. (s.f.). Fakta o deuteriu. Obnoveno z thoughtco.com



Zatím žádné komentáře