
Jaké je reakční teplo?

The reakční teplo nebo entalpie reakce (ΔH) je změna entalpie chemické reakce, ke které dochází při konstantním tlaku. Jedná se o termodynamickou měrnou jednotku užitečnou pro výpočet množství energie na mol, která se uvolní nebo vyprodukuje při reakci.
Vzhledem k tomu, že entalpie je odvozena z tlaku, objemu a vnitřní energie, z nichž všechny jsou stavovými funkcemi, je entalpie také stavovou funkcí..
ΔH nebo změna entalpie se objevila jako jednotka měření určená k výpočtu energetické změny systému, když bylo příliš obtížné najít ΔU nebo změnu vnitřní energie systému, přičemž se současně měnilo množství tepla a práce.
Při konstantním tlaku se změna entalpie rovná teplu a lze ji měřit jako ΔH = q.
Zápis ΔHº nebo ΔHºr pak vyvstává k vysvětlení přesné teploty a tlaku reakčního tepla ΔH.
Standardní entalpie reakce je symbolizována ΔHº nebo ΔHºrxn a může nabývat kladných i záporných hodnot. Jednotky pro ΔHº jsou kiloJouly na mol nebo kj / mol.
Předchozí koncept pro pochopení reakčního tepla: rozdíly mezi ΔH a ΔHºr.
Δ = představuje změnu entalpie (entalpie produktů minus entalpie reaktantů).
Kladná hodnota znamená, že produkty mají vyšší entalpii nebo že jde o endotermickou reakci (je zapotřebí teplo).
Záporná hodnota znamená, že reaktanty mají vyšší entalpii, nebo že jde o exotermickou reakci (vzniká teplo).
º = znamená, že reakce je standardní změnou entalpie a probíhá při přednastaveném tlaku / teplotě.
r = označuje, že tato změna je entalpií reakce.
Standardní stav: standardní stav pevné nebo kapalné látky je čistá látka při tlaku 1 bar nebo stejné atmosféře 1 (105 Pa) a teplotě 25 ° C nebo stejné 298 K.
ΔHºr je standardní reakční teplo nebo standardní entalpie reakce a jako ΔH také měří entalpii reakce. ΔHºrxn však probíhá za „standardních“ podmínek, což znamená, že reakce probíhá při 25 ° C a 1 atm..
Výhodou měření ΔH za standardních podmínek je schopnost spojit jednu hodnotu ΔHº s jinou, protože se vyskytují za stejných podmínek.
Teplo formace
Standardní teplo formace, ΔHFº chemického produktu je množství tepla absorbovaného nebo uvolněného z tvorby 1 molu této chemikálie při 25 stupních Celsia a 1 baru jejích prvků v jejich standardních stavech.
Prvek je ve standardním stavu, pokud je ve své nejstabilnější formě a ve svém fyzickém stavu (pevný, kapalný nebo plynný) při teplotě 25 stupňů Celsia a 1 baru.
Například standardní teplo tvorby oxidu uhličitého zahrnuje kyslík a uhlík jako reaktanty..
Kyslík je stabilnější jako molekuly O plynudva, zatímco uhlík je stabilnější jako pevný grafit. (Grafit je za standardních podmínek stabilnější než diamant).
Abychom definici vyjádřili jiným způsobem, je standardní teplo formace zvláštním typem standardního reakčního tepla..
Reakcí je tvorba 1 molu chemikálie z jejích prvků v jejich standardních stavech za standardních podmínek.
Standardní teplo formace se také nazývá standardní entalpie formace (i když ve skutečnosti jde o změnu entalpie).
Podle definice by tvorba prvku sama o sobě nevedla k žádné změně entalpie, takže standardní reakční teplo pro všechny prvky je nulové (Cai, 2014).
Výpočet entalpie reakce
1- Experimentální výpočet
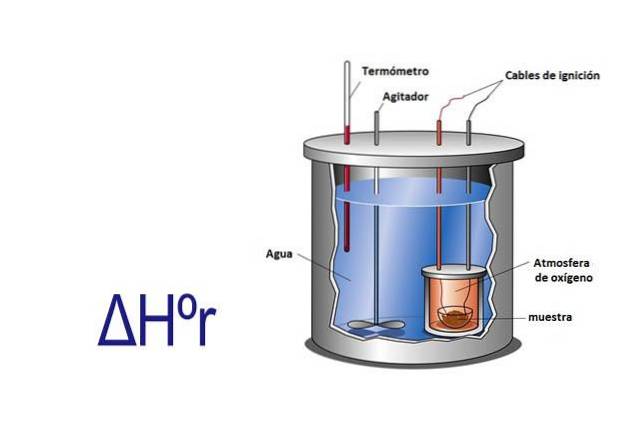
Entalpie lze měřit experimentálně pomocí kalorimetru. Kalorimetr je přístroj, kde vzorek reaguje elektrickými kabely, které poskytují aktivační energii. Vzorek je v nádobě obklopené vodou, která je neustále míchána.
Měřením se změnou teploty, ke které dochází, když vzorek reaguje, a znalostí specifického tepla vody a její hmotnosti se teplo uvolněné nebo absorbované reakcí vypočítá pomocí rovnice q = Cesp x m x ΔT.
V této rovnici q je teplo, Cesp je specifické teplo v tomto případě vody, které se rovná 1 kalorii na gram, m je hmotnost vody a ΔT je změna teploty.
Kalorimetr je izolovaný systém, který má konstantní tlak, tedy ΔHr= q
2- Teoretický výpočet
Změna entalpie nezávisí na konkrétní cestě reakce, ale pouze na globální energetické úrovni produktů a reaktantů. Entalpie je funkcí státu a jako taková je aditivní.
Pro výpočet standardní entalpie reakce můžeme přidat standardní entalpie tvorby reaktantů a odečíst je od součtu standardních entalpií tvorby produktů (Boundless, S.F.). Matematicky řečeno, toto nám dává:
ΔHr° = Σ ΔHFº (produkty) - Σ ΔHFº (reaktanty).
Entalpie reakcí se obvykle počítají z entalpií tvorby reaktantů za normálních podmínek (tlak 1 bar a teplota 25 stupňů Celsia).
Abychom vysvětlili tento princip termodynamiky, vypočítáme entalpii reakce na spalování metanu (CH4) podle vzorce:
CH4 (g) +20dva (g) → COdva (g) + 2HdvaO (g)
Pro výpočet standardní entalpie reakce musíme najít standardní entalpie tvorby každého z reaktantů a produktů zapojených do reakce..
Ty se obvykle nacházejí v příloze nebo v různých tabulkách online. Pro tuto reakci potřebujeme následující údaje:
HFº CH4 (g) = -75 kjoul / mol.
HFº Odva (g) = 0 kjoul / mol.
HFº COdva (g) = -394 kjoul / mol.
HFº HdvaO (g) = -284 kjoul / mol.
Všimněte si, že protože je ve svém standardním stavu, standardní entalpie tvorby kyslíkového plynu je 0 kJ / mol.
Zde shrneme naše standardní entalpie formace. Všimněte si, že protože jednotky jsou v kJ / mol, musíme ve vyvážené reakční rovnici vynásobit stechiometrickými koeficienty (Leaf Group Ltd, S.F.).
Σ ΔHFº (produkty) = ΔHFº COdva +2 ΔHFº HdvaNEBO
Σ ΔHFº (produkty) = -1 (394 kjoul / mol) -2 (284 kjoul / mol) = -962 kjoul / mol
Σ ΔHFº (reaktanty) = ΔHFº CH4 + ΔHFº Odva
Σ ΔHFº (reaktanty) = -75 kjoul / mol + 2 (0 kjoul / mol) = -75 kjoul / mol
Nyní můžeme najít standardní entalpii reakce:
ΔHr° = Σ ΔHFº (produkty) - Σ ΔHFº (reaktanty) = (- 962) - (- 75) =
ΔHr° = - 887 kJ / mol.
Reference
- Anne Marie Helmenstine. (2014, 11. června). Definice entalpie reakce. Obnoveno z thoughtco: thoughtco.com.
- (S.F.). Standardní entalpie reakce. Obnoveno z boundless: boundless.com.
- Cai, E. (2014, 11. března). standardní teplo formace. Obnoveno z chemického statistika: chemicalstatistician.wordpress.com.
- Clark, J. (2013, květen). Různé definice změny entalpie. Obnoveno z chemguide.co.uk: chemguide.co.uk.
- Jonathan Nguyen, G. L. (2017, 9. února). Standardní entalpie formace. Obnoveno z chem.libretexts.org: chem.libretexts.org.
- Leaf Group Ltd. (S.F.). Jak vypočítat entalpie reakce. Obnoveno ze sciencing: sciencing.com.
- Rachel Martin, E. Y. (2014, 7. května). Reakční teplo. Obnoveno z chem.libretexts.org: chem.libretexts.org.



Zatím žádné komentáře