
Jaká je konfigurace externích elektronů?

The elektronická konfigurace, Také se nazývá elektronová struktura, jedná se o uspořádání elektronů v energetických úrovních kolem atomového jádra. Podle starého Bohrova atomového modelu zaujímají elektrony různé úrovně na oběžných drahách kolem jádra, od prvního pláště nejblíže k jádru, K, až po sedmé pláště, Q, které je od jádra nejdále..
Pokud jde o propracovanější kvantově mechanický model, jsou skořápky K-Q rozděleny na sadu orbitalů, z nichž každý může být obsazen ne více než jedním párem elektronů..
Obvykle se elektronová konfigurace používá k popisu orbitalů atomu v jeho základním stavu, ale lze jej také použít k reprezentaci atomu, který se ionizoval na kation nebo anion, čímž kompenzuje ztrátu nebo zisk elektronů v příslušných orbitálech ..
Mnoho z fyzikálních a chemických vlastností prvků lze korelovat s jejich jedinečnými elektronickými konfiguracemi. Valenční elektrony, elektrony v nejvzdálenějším plášti, jsou určujícím faktorem pro jedinečnou chemii prvku..
Základy elektronových konfigurací
Před přiřazením elektronů atomu k orbitalům by se měl člověk seznámit se základy elektronových konfigurací. Každý prvek v periodické tabulce se skládá z atomů, které jsou tvořeny protony, neutrony a elektrony..
Elektrony vykazují záporný náboj a nacházejí se kolem jádra atomu na orbitálech elektronu, což je definováno jako objem prostoru, ve kterém lze elektron nalézt s pravděpodobností 95%..
Čtyři různé typy orbitalů (s, p, d a f) mají různé tvary a jeden orbitál může obsahovat maximálně dva elektrony. Orbitály p, d a f mají různé podúrovně, takže mohou obsahovat více elektronů.
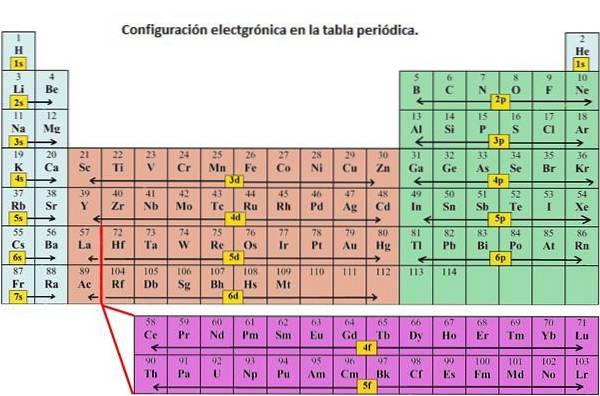
Jak je uvedeno, elektronová konfigurace každého prvku je jedinečná pro jeho polohu v periodické tabulce. Úroveň energie je určena periodou a počet elektronů je dán atomovým číslem prvku.
Orbitaly na různých energetických úrovních jsou si navzájem podobné, ale zabírají různé oblasti ve vesmíru..
Orbitál 1 s a orbitál 2 s mají vlastnosti s orbitálu (radiální uzly, pravděpodobnosti sférického objemu, mohou obsahovat pouze dva elektrony atd.). Ale protože jsou na různých energetických úrovních, zabírají různé prostory kolem jádra. Každý orbitál může být reprezentován konkrétními bloky v periodické tabulce..
Blok s je oblast alkalických kovů včetně helia (skupiny 1 a 2), blok d je přechodné kovy (skupiny 3 až 12), blok p je prvky hlavní skupiny skupin 13 až 18 a blok f je řady lanthanoidů a aktinidů.

Princip Aufbau
Aufbau pochází z německého slova „Aufbauen“, což znamená „stavět“. V podstatě vytvářením elektronových konfigurací vytváříme elektronové orbitaly při přechodu z jednoho atomu na druhý..
Když píšeme elektronovou konfiguraci atomu, vyplníme orbitaly ve vzestupném pořadí podle atomového čísla.
Princip Aufbau pochází z Pauliho vylučovacího principu, který říká, že v atomu nejsou žádné dva fermiony (např. Elektrony). Mohou mít stejnou množinu kvantových čísel, takže se musí „skládat“ na vyšší energetické úrovně.
Jak se elektrony hromadí, je téma elektronových konfigurací (Aufbau Principle, 2015).
Stabilní atomy mají v elektronu tolik elektronů, kolik mají protony. Elektrony se shromažďují kolem jádra v kvantových orbitálech podle čtyř základních pravidel nazývaných Aufbauův princip..
- V atomu nejsou žádné dva elektrony, které sdílejí stejná čtyři kvantová čísla n, l, m a s.
- Elektrony nejprve obsadí orbitaly s nejnižší úrovní energie.
- Elektrony vždy naplní orbitaly stejným číslem rotace. Až budou orbitaly plné, začne to.
- Elektrony vyplní orbitaly součtem kvantových čísel n a l. Orbitály se stejnými hodnotami (n + l) budou vyplněny nejprve nižšími n hodnotami.
Druhé a čtvrté pravidlo jsou v zásadě stejné. Příkladem pravidla čtyři by byly orbitály 2p a 3s.
2p orbitál je n = 2 al = 2 a 3s orbitál je n = 3 al = 1 (N + l) = 4 v obou případech, ale 2p orbitál má nejnižší energii nebo nejnižší hodnotu n a bude vyplňte před vrstvou 3 s.
Naštěstí lze k plnění elektronů použít Moellerův diagram znázorněný na obrázku 2. Graf se čte spuštěním úhlopříček od 1 s.
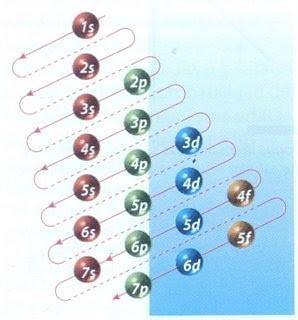
Obrázek 2 ukazuje atomové orbitaly a šipky sledují cestu vpřed.
Nyní, když je známo, že je vyplněno pořadí orbitalů, zbývá už jen zapamatovat si velikost každé orbity.
S orbitaly mají 1 možnou hodnotu ml držet 2 elektrony
P orbitaly mají 3 možné hodnoty ml pojmout 6 elektronů
D orbitaly mají 5 možných hodnot ml pojmout 10 elektronů
F orbitaly mají 7 možných hodnot ml pojmout 14 elektronů
To je vše, co je potřeba k určení elektronické konfigurace stabilního atomu prvku..
Vezměte například prvek dusík. Dusík má sedm protonů, a tedy sedm elektronů. První vyplněný orbitál je orbitál 1 s.
Orbitál má dva elektrony, takže zbývá pět elektronů. Další orbitál je orbitál 2 s a obsahuje další dva. Poslední tři elektrony půjdou na 2p oběžnou dráhu, která pojme až šest elektronů (Helmenstine, 2017).
Důležitost konfigurace vnějších elektronů
Konfigurace elektronů hraje důležitou roli při určování vlastností atomů.
Všechny atomy stejné skupiny mají stejnou vnější elektronickou konfiguraci s výjimkou atomového čísla n, a proto mají podobné chemické vlastnosti.
Mezi klíčové faktory, které ovlivňují atomové vlastnosti, patří velikost největších okupovaných orbitalů, energie orbitálů s vyšší energií, počet volných míst na oběžné dráze a počet elektronů na orbitálech s vyšší energií..
Většina atomových vlastností může souviset se stupněm přitažlivosti mezi nejvzdálenějšími elektrony k jádru a počtem elektronů v nejvzdálenějším elektronovém obalu, počtem valenčních elektronů.
Elektrony vnějšího pláště jsou ty, které mohou vytvářet kovalentní chemické vazby, jsou to ty, které mají schopnost ionizovat za vzniku kationtů nebo aniontů a jsou to ty, které dávají oxidační stav chemickým prvkům.
Rovněž určí atomový poloměr. Jak se n zvětšuje, atomový poloměr se zvyšuje. Když atom ztratí elektron, dojde ke kontrakci poloměru atomu v důsledku snížení záporného náboje kolem jádra..
Elektrony vnějšího pláště jsou ty, které jsou brány v úvahu teorií valenčních vazeb, teorií krystalického pole a teorií molekulárních orbitů k získání vlastností molekul a hybridizací vazeb..
Reference
- Princip Aufbau. (2015, 3. června). Citováno z chem.libretexts: chem.libretexts.org.
- Bozeman Science. (2013, Vyčerpáno 4). Konfigurace elektronů. Převzato z youtube: youtube.com.
- Konfigurace elektronů a vlastnosti atomů. (S.F.). Převzato z oneonta.edu: oneonta.edu.
- Encyklopedie Britannica. (2011, 7. září). Elektronická konfigurace. Převzato z britannica: britannica.com.
- Faizi, S. (2016, 12. července). Elektronické konfigurace. Převzato z chem.libretexts: chem.libretexts.org.
- Helmenstine, T. (2017, 7. března). Princip Aufbau - elektronická struktura a princip Aufbau. Převzato z thoughtco: thoughtco.com.
- Khan, S. (2014, 8. června). Valenční elektrony a vazba. Převzato z khanacademy: khanacademy.org.


Zatím žádné komentáře