
Co je spektrální notace?
The spektrální notace je uspořádání elektronů v energetických úrovních kolem jádra atomu. Podle starého Bohrova atomového modelu zaujímají elektrony různé úrovně na oběžných drahách kolem jádra, od prvního pláště nejblíže k jádru, K, až po sedmé pláště, Q, které je od jádra nejdále..
Pokud jde o propracovanější kvantově mechanický model, jsou skořápky K-Q rozděleny na sadu orbitalů, z nichž každý může být obsazen ne více než jedním párem elektronů..

Obvykle se elektronová konfigurace používá k popisu orbitalů atomu v jeho základním stavu, ale lze jej také použít k reprezentaci atomu, který se ionizoval na kation nebo anion, čímž kompenzuje ztrátu nebo zisk elektronů v příslušných orbitálech ..
Mnoho z fyzikálních a chemických vlastností prvků lze korelovat s jejich jedinečnými elektronickými konfiguracemi. Valenční elektrony, elektrony v nejvzdálenějším plášti, jsou určujícím faktorem pro jedinečnou chemii prvku..
Když elektrony v nejvzdálenějším pouzdru atomu přijímají energii nějakého druhu, přesouvají se do vyšších energetických vrstev. Takže elektron v plášti K bude přenesen do pláště L ve stavu vyšší energie.
Když se elektron vrátí do základního stavu, uvolní energii, kterou absorboval, vyzařováním elektromagnetického spektra (světla). Protože každý atom má specifickou elektronickou konfiguraci, bude mít také specifické spektrum, které se bude nazývat absorpční (nebo emisní) spektrum..
Z tohoto důvodu se termín spektrální notace používá k označení elektronové konfigurace.
Jak určit spektrální notaci: kvantová čísla
K úplnému popisu pohybu a trajektorií každého elektronu v atomu se používají celkem čtyři kvantová čísla..
Kombinace všech kvantových čísel všech elektronů v atomu je popsána vlnovou funkcí, která splňuje Schrödingerovu rovnici. Každý elektron v atomu má jedinečnou sadu kvantových čísel.
Podle Pauliho vylučovacího principu nemohou dva elektrony sdílet stejnou kombinaci čtyř kvantových čísel.
Kvantová čísla jsou důležitá, protože je lze použít k určení elektronové konfigurace atomu a pravděpodobného umístění elektronů v atomu..
Kvantová čísla se také používají k určení dalších charakteristik atomů, jako je ionizační energie a poloměr atomu..
Kvantová čísla označují konkrétní skořápky, dílčí skořápky, orbitaly a otáčení elektronů.
To znamená, že plně popisují vlastnosti elektronu v atomu, to znamená, že popisují každé jedinečné řešení Schrödingerovy rovnice nebo vlnové funkce elektronů v atomu..
Existují celkem čtyři kvantová čísla: hlavní kvantové číslo (n), kvantové číslo orbitální momentu hybnosti (l), magnetické kvantové číslo (ml) a kvantové číslo elektronového spinu (ms).
Hlavní kvantové číslo, nn, popisuje energii elektronu a nejpravděpodobnější vzdálenost elektronu od jádra. Jinými slovy to znamená velikost orbitálu a energetickou hladinu, na které je umístěn elektron..
Počet dílčích skořápek neboli II popisuje tvar oběžné dráhy. Lze jej také použít k určení počtu úhlových uzlů.
Magnetické kvantové číslo, ml, popisuje energetické úrovně v subshell a ms označuje spin na elektronu, který může být nahoru nebo dolů..
Princip Aufbau
Aufbau pochází z německého slova „Aufbauen“, což znamená „stavět“. V podstatě vytvářením elektronových konfigurací vytváříme elektronové orbitaly při přechodu z jednoho atomu na druhý..
Když píšeme elektronovou konfiguraci atomu, vyplníme orbitaly ve vzestupném pořadí podle atomového čísla.
Princip Aufbau pochází z Pauliho vylučovacího principu, který říká, že v atomu nejsou žádné dva fermiony (např. Elektrony).
Mohou mít stejnou množinu kvantových čísel, takže se musí „skládat“ na vyšší energetické úrovně. Jak se elektrony akumulují, je otázkou elektronových konfigurací.
Stabilní atomy mají v elektronu tolik elektronů, kolik mají protony. Elektrony se shromažďují kolem jádra v kvantových orbitálech podle čtyř základních pravidel nazývaných Aufbauův princip..
- V atomu nejsou žádné dva elektrony, které sdílejí stejná čtyři kvantová čísla n, l, m a s.
- Elektrony nejprve obsadí orbitaly s nejnižší úrovní energie.
- Elektrony vždy naplní orbitaly stejným číslem rotace. Až budou orbitaly plné, začne to.
- Elektrony vyplní orbitaly součtem kvantových čísel n a l. Orbitály se stejnými hodnotami (n + l) budou vyplněny nejprve nižšími n hodnotami.
Druhé a čtvrté pravidlo jsou v zásadě stejné. Příkladem pravidla čtyři by byly orbitály 2p a 3s.
2p orbitál je n = 2 al = 2 a 3s orbitál je n = 3 al = 1 (N + l) = 4 v obou případech, ale 2p orbitál má nejnižší energii nebo nejnižší hodnotu n a bude vyplňte před vrstvou 3 s.
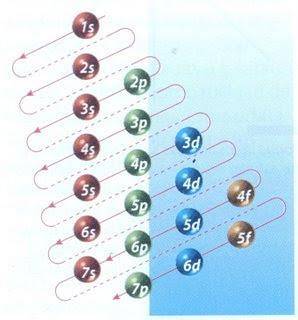
Naštěstí lze k plnění elektronů použít Moellerův diagram znázorněný na obrázku 2. Graf se čte spuštěním úhlopříček od 1 s.
Obrázek 2 ukazuje atomové orbitaly a šipky sledují cestu vpřed.
Nyní, když je známo, že je vyplněno pořadí orbitalů, zbývá už jen zapamatovat si velikost každé orbity.
S orbitaly mají 1 možnou hodnotu ml držet 2 elektrony
P orbitaly mají 3 možné hodnoty ml pojmout 6 elektronů
D orbitaly mají 5 možných hodnot ml pojmout 10 elektronů
F orbitaly mají 7 možných hodnot ml pojmout 14 elektronů
To je vše, co je potřeba k určení elektronické konfigurace stabilního atomu prvku..
Vezměte například prvek dusík. Dusík má sedm protonů, a tedy sedm elektronů. První vyplněný orbitál je orbitál 1 s. Orbitál má dva elektrony, takže zbývá pět elektronů.
Další orbitál je orbitál 2 s a obsahuje další dva. Poslední tři elektrony půjdou na 2p oběžnou dráhu, která pojme až šest elektronů.
Hund pravidla
Sekce Aufbau diskutovala o tom, jak elektrony nejprve naplňují orbitaly s nejnižší energií a poté se pohybují nahoru na orbitaly s nejvyšší energií až po naplnění orbitalů s nejnižší energií..
S tímto pravidlem však existuje problém. Orbitály 1 s jistě musí být vyplněny před orbitály 2 s, protože orbitaly 1 s mají nižší hodnotu n, a tedy nižší energii..
A tři různé 2p orbitaly? V jakém pořadí by měly být vyplněny? Odpověď na tuto otázku zahrnuje Hundovo pravidlo.
Hundovo pravidlo říká, že:
- Každý orbitál v podúrovni je jednotlivě obsazen před tím, než je jakýkoli orbitál obsazen dvojnásobně.
- Všechny elektrony na jednotlivě obsazených orbitálech mají stejné otáčení (pro maximalizaci celkového otáčení).
Když jsou elektrony přiřazeny orbitálům, elektron se nejprve snaží naplnit všechny orbitaly podobnou energií (nazývanou také degenerované orbitaly), než se spáruje s jiným elektronem v poloplném orbitálu..
Atomy v základních stavech mívají co nejvíce nepárových elektronů. Při vizualizaci tohoto procesu zvažte, jak elektrony vykazují stejné chování jako stejné póly v magnetu, pokud by měly přijít do kontaktu..
Když záporně nabité elektrony naplní orbitaly, nejprve se pokusí dostat co nejdále od sebe, než se budou muset spárovat..
Reference
- Anastasiya Kamenko, T. E. (2017, 24. března). Kvantová čísla. Obnoveno z chem.libretexts.org.
- Princip Aufbau. (2015, 3. června). Obnoveno z chem.libretexts.org.
- Konfigurace elektronů a vlastnosti atomů. (S.F.). Obnoveno z oneonta.edu.
- Encyklopedie Britannica. (2011, 7. září). Elektronická konfigurace. Obnoveno z britannica.com.
- Helmenstine, T. (2017, 7. března). Princip Aufbau - elektronická struktura a princip Aufbau. Obnoveno z thoughtco.com.
- Hundova pravidla. (2015, 18. července). Obnoveno z chem.libretexts.org.
- Spektroskopická notace. (S.F.). Obnoveno z bcs.whfreeman.com.



Zatím žádné komentáře