
Co jsou vodné roztoky? (S příklady)
The vodní roztoky jsou ta řešení, která používají vodu k rozložení látky. Například bahno nebo cukrová voda. Když se chemická látka rozpustí ve vodě, je to označeno psaním (aq) za chemickým názvem.
Hydrofilní (vodu milující) látky a mnoho iontových sloučenin se ve vodě rozpouští nebo disociuje. Například když se kuchyňská sůl nebo chlorid sodný rozpouští ve vodě, disociuje se na své ionty za vzniku Na + (aq) a Cl- (aq).

Hydrofobní látky, které se bojí vody, se obecně nerozpouštějí ve vodě ani netvoří vodné roztoky. Například míchání oleje a vody nevede k rozpuštění nebo disociaci.
Mnoho organických sloučenin je hydrofobních. Neelektrolyty se mohou rozpustit ve vodě, ale nerozcházejí se na ionty a udržují si svou integritu jako molekuly. Mezi příklady neelektrolytů patří cukr, glycerol, močovina a methylsulfonylmethan (MSM).
Vlastnosti vodných roztoků
Vodné roztoky často vedou elektřinu. Roztoky obsahující silné elektrolyty bývají dobrými elektrickými vodiči (např. Mořská voda), zatímco roztoky obsahující slabé elektrolyty bývají špatnými vodiči (např. Voda z vodovodu).
Důvodem je to, že silné elektrolyty se ve vodě úplně disociují na ionty, zatímco slabé elektrolyty se disociují neúplně..
Když ve vodném roztoku dochází k chemickým reakcím mezi druhy, jedná se obvykle o reakce s dvojitým vytěsněním (nazývané také metathéza nebo dvojitá substituce)..
V tomto typu reakce zaujímá kation v jednom činidle místo kationu v druhém činidle, obvykle tvoří iontovou vazbu. Další způsob uvažování je, že reaktivní ionty „mění partnery“.
Reakcemi ve vodném roztoku mohou vznikat produkty, které jsou rozpustné ve vodě nebo mohou vytvářet sraženinu..
Sraženina je sloučenina s nízkou rozpustností, která často vypadne z roztoku jako pevná látka..
Pojmy kyselina, báze a pH se vztahují pouze na vodné roztoky. Můžete například změřit pH citronové šťávy nebo octa (dva vodné roztoky) a jsou to slabé kyseliny, ale z testu rostlinného oleje s pH papírem nemůžete získat žádnou smysluplnou informaci..
Proč se některé pevné látky rozpouštějí ve vodě?
Cukr, který používáme k oslazování kávy nebo čaje, je molekulární pevná látka, ve které jsou jednotlivé molekuly drženy pohromadě relativně slabými mezimolekulárními silami..
Když se cukr rozpustí ve vodě, dojde k porušení slabých vazeb mezi jednotlivými molekulami sacharózy a tyto molekuly C12H22O11 se uvolní do roztoku..
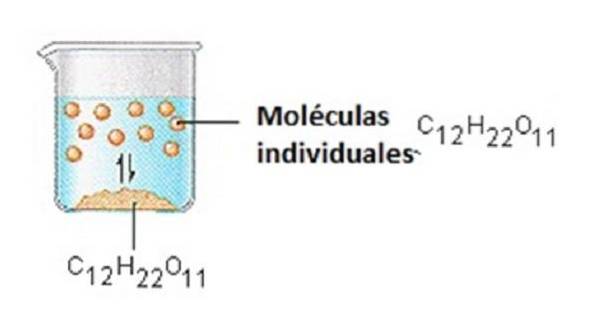
K rozbití vazeb mezi molekulami C12H22O11 v sacharóze je zapotřebí energie. K rozbití vodíkových vazeb ve vodě je také zapotřebí energie, kterou je nutné rozbít, aby se jedna z těchto molekul sacharózy vložila do roztoku..
Cukr se rozpouští ve vodě, protože energie se uvolňuje, když mírně polární molekuly sacharózy vytvoří intermolekulární vazby s polárními molekulami vody..
Slabé vazby, které se tvoří mezi rozpuštěnou látkou a rozpouštědlem, kompenzují energii potřebnou ke změně struktury čisté rozpuštěné látky i rozpouštědla..
V případě cukru a vody tento proces funguje tak dobře, že v jednom litru vody lze rozpustit až 1 800 gramů sacharózy..
Iontové pevné látky (nebo soli) obsahují kladné a záporné ionty, které jsou drženy pohromadě díky velké síle přitažlivosti mezi částicemi s opačnými náboji.
Když se jedna z těchto pevných látek rozpustí ve vodě, ionty, které tvoří pevnou látku, se uvolní do roztoku, kde se spojí s molekulami polárního rozpouštědla..
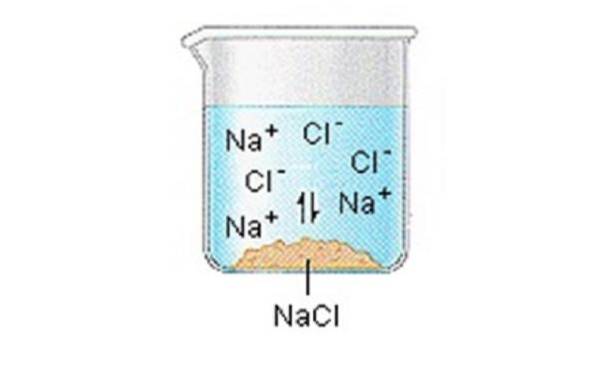
NaCl (s) ”Na + (aq) + Cl- (aq)
Obecně lze předpokládat, že se soli disociují na své ionty, když jsou rozpuštěny ve vodě..
Iontové sloučeniny se rozpouštějí ve vodě, pokud energie uvolněná při interakci iontů s molekulami vody převáží energii potřebnou k rozbití iontových vazeb v pevné látce a energii potřebnou k oddělení molekul vody, aby mohly být ionty vloženy do roztoku.
Pravidla rozpustnosti
V závislosti na rozpustnosti rozpuštěné látky existují tři možné výsledky:
1) Pokud má roztok méně rozpuštěné látky než maximální množství, které je schopen rozpustit (jeho rozpustnost), jedná se o zředěný roztok;
2) Pokud je množství rozpuštěné látky přesně stejné množství jako její rozpustnost, je nasyceno;
3) Je-li více rozpuštěné látky, než je schopno rozpustit, přebytečná rozpuštěná látka se oddělí od roztoku.
Pokud tento separační proces zahrnuje krystalizaci, vytvoří se sraženina. Srážení snižuje koncentraci rozpuštěné látky na nasycení, aby se zvýšila stabilita roztoku..
Následují pravidla rozpustnosti pro běžné iontové pevné látky. Pokud se zdá, že si dvě pravidla navzájem odporují, přednost má předchozí.
1 - Soli obsahující prvky skupiny I (Li+, Na+, K.+, Čs+, Rb+) jsou rozpustné. Z tohoto pravidla existuje několik výjimek. Soli obsahující amonný iont (NH4+) jsou také rozpustné.
2 - Soli obsahující dusičnany (č3-) jsou obecně rozpustné.
3- Soli, které obsahují Cl -, Br - nebo I - jsou obecně rozpustné. Důležitými výjimkami z tohoto pravidla jsou halogenidové soli Ag+, Pb2+ a (Hg2)dva+. AgCl, PbBrdva a HgdvaCldva jsou nerozpustné.
4 - Většina solí stříbra je nerozpustná. AgNO3 a Ag (C.dvaH3NEBOdva) jsou běžné rozpustné soli stříbra; Prakticky všichni ostatní jsou nerozpustní.
5 - Většina síranových solí je rozpustných. Mezi důležité výjimky z tohoto pravidla patří CaSO4, Baso4, PbSO4, AgdvaSO4 a SrSO4.
6- Většina hydroxidových solí je jen málo rozpustná. Hydroxidové soli prvků skupiny I jsou rozpustné. Hydroxidové soli prvků skupiny II (Ca, Sr a Ba) jsou málo rozpustné.
Hydroxidové soli přechodných kovů a Al3 + jsou nerozpustné. Fe (OH)3, Al (OH)3, Co (OH)dva nejsou rozpustné.
7- Většina sulfidů přechodných kovů je vysoce nerozpustná, včetně CdS, FeS, ZnS a AgdvaS. Arsen, antimon, vizmut a sulfidy olova jsou také nerozpustné.
8- Uhličitany jsou často nerozpustné. Uhličitany skupiny II (CaCO3, SrCO3 a BaCO3) jsou nerozpustné, stejně jako FeCO3 a PbCO3.
9- Chromany jsou často nerozpustné. Mezi příklady patří PbCrO4 a BaCrO4.
10- Fosfáty, jako je Ca3(PO4)dva a Ag3PO4 jsou často nerozpustné.
11- Fluoridy, jako je BaFdva, MgFdva a PbFdva jsou často nerozpustné.
Příklady rozpustnosti ve vodných roztocích
Cola, slaná voda, déšť, kyselé roztoky, bazické roztoky a solné roztoky jsou příklady vodných roztoků. Když máte vodný roztok, můžete vyvolat sraženinu srážením.
Srážkové reakce se někdy nazývají reakce „dvojitého posunutí“. Chcete-li zjistit, zda se při smíchání vodných roztoků dvou sloučenin vytvoří sraženina:
- Zaznamenejte všechny ionty v roztoku.
- Zkombinujte je (kation a anion) a získejte všechny potenciální sraženiny.
- Pomocí pravidel rozpustnosti určete, která (pokud existuje) kombinace je nerozpustná a bude se srážet.
Příklad 1: Co se stane, když Ba (NO3)dva (aq) a NadvaCO3 (aq)?
Iony přítomné v roztoku: Badva+, NE3-, Na+, CO3dva-
Potenciální sraženiny: BaCO3, NaNO3
Pravidla rozpustnosti: BaCO3 je nerozpustný (pravidlo 5), NaNO3 je rozpustný (pravidlo 1).
Kompletní chemická rovnice:
Koupel3)dva(aq) + NadvaCO3(aq) “BaCO3(s) + 2NaNO3 (aq)
Čistá iontová rovnice:
Badva+(aq) + CO3dva-(aq) „BaCO3 (s)
Příklad 2: Co se stane, když Pb (NO3)dva (aq) a NH4Já (aq)?
Iony přítomné v roztoku: Pbdva+, NE3-, NH4+, Já-
Potenciální sraženiny: PbIdva, NH4NE3
Pravidla rozpustnosti: PbIdva je nerozpustný (pravidlo 3), NH4NE3 je rozpustný (pravidlo 1).
Kompletní chemická rovnice: Pb (NO3)2 (aq) + 2NH4Já(aq) “PbI2 (s) + 2NH4NE3 (aq)
Čistá iontová rovnice: Pbdva+(aq) + 2I-(aq) “PbI2 (s).
Reference
- Anne Marie Helmenstine. (2017, 10. května). Vodná definice (vodný roztok). Obnoveno z thoughtco.com.
- Anne Marie Helmenstine. (2017, 14. května). Definice vodného roztoku v chemii. Obnoveno z thoughtco.com.
- Antoinette Mursa, K. W. (2017, 14. května). Pravidla rozpustnosti. Obnoveno z chem.libretexts.org.
- Vodní roztoky. (S.F.). Obnoveno z saylordotorg.github.io.
- Berkey, M. (2011, 11. listopadu). Vodné roztoky: Definice a příklady. Obnoveno z youtube.com.
- Reakce ve vodném roztoku. (S.F.). Obnoveno z chemistry.bd.psu.edu.
- Reid, D. (S.F.). Vodný roztok: definice, reakce a příklad. Obnoveno ze studie.com.
- Rozpustnost. (S.F.). Obnoveno z chemed.chem.purdue.edu.



Zatím žádné komentáře