
Co jsou to anorganické chemické funkce?
The anorganické chemické funkce jsou rodiny anorganických sloučenin, které mají podobné chemické vlastnosti. Tyto chemické funkce se skládají z pěti skupin: oxidy, zásady nebo hydroxidy, kyseliny, soli a hydridy..
Každá chemická funkce je definována sadou atomů, které je identifikují. Tímto způsobem je možné identifikovat funkci, ke které chemická sloučenina patří podle jejích prvků..

V tomto smyslu můžeme potvrdit, že skupina OH definuje chemickou funkci hydroxidu. Proto bude NaOH (hydroxid sodný) patřit do skupiny hydroxidů.
Anorganické chemické funkce využívají chemické sloučeniny minerálního původu. Sůl, voda, zlato, olovo, sádra a mastek jsou příklady běžných anorganických sloučenin..
Všechny anorganické sloučeniny existovaly na planetě Zemi před vznikem života. S atomovou teorií, vývojem periodické tabulky a radiochemií bylo možné definovat pět funkcí anorganické chemie.
První výzkumy a přístupy k této problematice proběhly na počátku 19. století a byly založeny na studiu jednoduchých anorganických sloučenin (solí a plynů)..
Rejstřík článků
- 1 Anorganické chemické funkce
- 1.1 - Oxidy
- 1.2 - Zásady nebo hydroxidy
- 1.3 - Kyseliny
- 1.4 - Soli
- 1,5 - Hydridy
- 2 Odkazy
Anorganické chemické funkce
- Oxidy

Oxidy jsou dvojné nebo binární sloučeniny, kde je jeden nebo více atomů kyslíku kombinováno s jinými prvky. Z tohoto důvodu existuje řada druhů oxidů v různých skupenstvích látek (pevných, kapalných a plynných).
Kyslík vždy přispívá oxidačním stavem -2 a téměř všechny prvky, které se s ním kombinují, vedou ke vzniku stabilních sloučenin v různých stupních oxidace..
Díky nim mají získané sloučeniny různé vlastnosti a mohou mít jak kovalentní, tak pevné iontové vazby..
Základní oxidy
Zásadité oxidy jsou sloučeniny odvozené ze směsi kyslíku s kovem (přechod, kovy alkalických zemin nebo zásady). Například kombinace hořčíku s kyslíkem vede k zásaditému oxidu, jako je tento:
2Mg + O2 → 2 MgO
Kov + kyslík = bazický oxid
2MgO = zásaditý oxid
Nomenklatura
Nomenklatura oxidů je vždy stejná. Nejprve je uveden obecný název sloučeniny (oxidu) a později je napsán název kovu. K tomu dochází, dokud je valence kovu pevná.
Příkladem může být oxid sodný nebo Na2O, kde nejdříve jde o kovový symbol a poté o kyslík s jeho valenčním nebo oxidačním stavem -2.
V případě základních oxidů existují tři typy nomenklatury: tradiční, atomová a skladová číslice. Název každého základního oxidu bude záviset na valenčním nebo oxidačním čísle každého prvku.
Vlastnosti
- Vždy se tvoří kombinací libovolného prvku s kyslíkem.
- Binární oxidy jsou ty, které se získávají smícháním kyslíku s jiným prvkem.
- K získání ternárního nebo směsného oxidu je nutné kombinovat binární sloučeninu s vodou (H2O).
- Existují směsné oxidy vznikající kombinací dvou různých prvků s kyslíkem.
- Zásady nebo hydroxidy

Jejich chuť je hořká, jejich struktura je na dotek mýdlová, jsou dobrými vodiči elektrického proudu ve vodném roztoku, jsou korozivní a při dotyku lakmusového papíru jej mění z růžové na modrou..
Vlastnosti
- Jsou odvozeny ze směsi bazického oxidu s vodou.
- Látky, které vytvářejí, mohou přijímat protony.
- Jsou to vodiče elektřiny zvané elektrolyty.
- Při kontaktu s vodou jsou rozpustné ve vodě.
- Jeho chuť je hořká.
- Jsou korozivní pro pokožku.
- Kyseliny

Kyseliny jsou anorganické sloučeniny, které vznikají smícháním vodíku s jakýmkoli prvkem nebo skupinou prvků s vysokou elektronegativitou.
Lze je snadno identifikovat podle jejich kyselé chuti, protože při přímém kontaktu s pokožkou mohou spálit pokožku a díky své schopnosti změnit barvu lakmusového papíru z modré na růžovou..
Hydracidy
Hydracidy jsou skupina kyselin odvozených z kombinace vodíku s nekovem. Příkladem může být kombinace chloru s vodíkem, která vede k kyselině chlorovodíkové, například:
Cl2 + H2 → 2HCL
Nekov + Vodík = Hydracid
H2CL = Hydracid
Oxokyseliny
Oxokyseliny jsou skupina kyselin odvozených z kombinace vody s kyselým oxidem. Příkladem může být kombinace oxidu sírového s vodou, která vede k kyselině sírové, například takto:
SO3 + H2O → H2SO4
Kyselý kysličník + voda = Okyselina
H2SO4 = oxokyselina
Vlastnosti
- Spálí pokožku, protože jsou žíravé.
- Jeho chuť je kyselá.
- Jsou to vodiče elektrického proudu.
- Při reakci s bází tvoří sůl a vodu.
- Při reakci s oxidem kovu tvoří sůl a vodu.
- Jdi ven
Soli jsou sloučeniny, které jsou odvozeny z kombinace báze s kyselinou. Obecně mají slanou chuť a jsou v kyselém stavu.
Jsou to dobré elektrické vodiče ve vodných roztocích. Kontakt s lakmusovým papírkem nemá vliv na jeho barvu.
Haloidy
Haloidové soli jsou ty, které postrádají kyslík a jsou tvořeny následujícími reakcemi:
1 - Při smíchání s halogenovým kovem. Příkladem může být kombinace hořčíku s kyselinou chlorovodíkovou za vzniku chloridu hořečnatého a vodíku, například takto:
Mg + 2HCl → MgCl2 + H2
2 - Při míchání aktivního kovu s hydracidem. Příkladem může být kombinace kyseliny bromovodíkové s oxidem sodným, jejímž výsledkem je bromid sodný a voda, například:
2HBr + 2NaO2 → NaBr + H2O
3 - Při míchání hydracidu s oxidem kovu. Příkladem může být kombinace kyseliny chlorovodíkové s hydroxidem sodným za vzniku chloridu sodného a vody, například takto:
HCl + NaOH → NaCl + H20
- Oxisales

Oxysolty jsou ty soli, které obsahují kyslík. Jsou vytvořeny takto:
1 - Při míchání hydracidu s hydroxidem. Toto je neutralizační proces. Příkladem může být směs hořčíku s kyselinou sírovou za vzniku síranu hořečnatého a vody, například takto:
Mg + H2SO4 → MgSO4 + H2O
2 - Při míchání oxokyseliny s aktivním kovem. Příkladem může být kombinace hydroxidu vápenatého s oxidem uhličitým za vzniku uhličitanu vápenatého a vody, například takto:
Ca (OH) 2 + CO2 → CaCO3 + H20
3 - Při míchání hydroxidu s anhydridem.
4 - Při míchání hydroxidu s kyselinou. Příkladem může být kombinace kyseliny dusičné s hydroxidem barnatým za vzniku dusičnanu barnatého a vody, například takto:
2HNO3 + Ba (OH) 2 → Ba (NO3) 2 + 2H20
Vlastnosti
- Mají slanou chuť.
- Mohou být kyselé nebo zásadité.
- Jsou to dobré elektrické vodiče.
- Hydridy
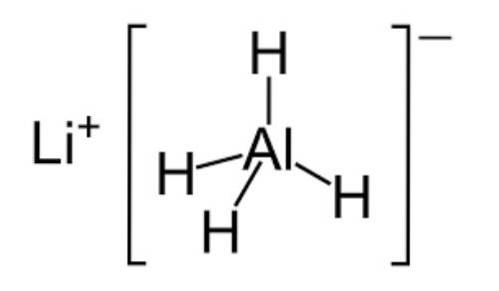
Hydridy jsou anorganické chemické sloučeniny tvořené vodíkem a jakýmkoli nekovovým prvkem.
Obvykle jsou v plynném stavu a mají podobné vlastnosti jako kyseliny. Existují však určité speciální hydridy, jako je voda (H2O), které mohou být při pokojové teplotě v kapalném stavu..
Nomenklatura
Chcete-li formulovat hydrid, nejprve napište symbol pro vodík a poté pro prvek.
K jejich pojmenování se přidá přípona uro a nekovový kořen, specifikující přítomnost vodíku. Některé příklady jsou následující:
HF = fluorovodík
HCl = chlorovodík
HBr = bromovodík
Reference
- (21. listopadu 2011). BuenasTareas.com. Získané z oxidů, kyselin, hydroxidů, halogenových solí atd.: Goodtasks.com.
- García, R. E. (2007). Anorganické chemické funkce a její nomenklatura. Redakční Trillas.
- House, J. E., & House, K. A. (2016). Deskriptivní anorganická chemie. Londýn: Elsevier.
- Vasquez, L. N. a Blanco, W. Y. (25. dubna 2013). Chemie. Získané z oxidů, hydroxidů, kyselin a solí: quimicanataliamywendyd.blogspot.com.
- Williams, A. (1979). Teoretický přístup k anorganické chemii. Berlín: Springer - Verlag.


Zatím žádné komentáře