
Vlastnosti endergonické reakce, příklady
A endergonická reakce Je to situace, která nemůže nastat spontánně a vyžaduje také vysoký přísun energie. V chemii je tato energie obecně kalorická. Nejznámější ze všech endergonických reakcí jsou endotermické reakce, tedy ty, které absorbují vznikající teplo.
Proč nejsou všechny reakce spontánní? Protože jdou nahoru k zákonům termodynamiky: spotřebovávají energii a systémy vytvořené zúčastněnými druhy snižují jejich entropii; to znamená, že pro chemické účely se stávají molekulárněji uspořádanými.

Stavba cihlové zdi je příkladem endergonické reakce. Samotné cihly nejsou dostatečně kompaktní, aby vytvořily pevné tělo. Je to proto, že neexistuje žádný energetický zisk, který by podporoval jejich odbory (což se také odráží v jejich možných nízkých mezimolekulárních interakcích).
K vybudování zdi tedy potřebujete cement a pracovní sílu. Jedná se o energii a spontánní reakce (stěna se nebude stavět automaticky) bude možná, pokud je vnímán energetický přínos (v případě zdi ekonomický).
Pokud to nebude mít žádnou výhodu, zeď se při jakémkoli rušení zhroutí a její cihly nikdy nebudou schopny držet pohromadě. Totéž platí o mnoha chemických sloučeninách, jejichž stavební kameny se nemohou spontánně spojit..
Rejstřík článků
- 1 Charakteristika endergonické reakce
- 1.1 Zvyšuje volnou energii systému
- 1.2 Vaše odkazy na produkty jsou slabší
- 1.3 Je spojen s exergonickými reakcemi
- 2 Příklady
- 2.1 Fotosyntéza
- 2.2 Syntéza biomolekul a makromolekul
- 2.3 Tvorba diamantů a těžkých sloučenin z ropy
- 3 Odkazy
Vlastnosti endergonické reakce
Co když lze zeď postavit spontánně? Za tímto účelem musí být interakce mezi cihlami velmi silná a stabilní, a to natolik, že je nebude muset objednávat žádný cement ani osoba; zatímco cihlová zeď, i když je odolná, je vytvrzený cement, který je drží pohromadě a není vhodným materiálem cihel.
Proto jsou první charakteristiky endergonické reakce:
-Není to spontánní
-Absorbuje teplo (nebo jinou energii)
A proč absorbuje energii? Protože její produkty mají více energie než reaktanty zapojené do reakce. To lze vyjádřit následující rovnicí:
ΔG = Gprodukty-GČinidla
Kde ΔG je změna Gibbsovy volné energie. Jako GProdukt je větší (protože je energičtější) než GČinidla, odečet musí být větší než nula (ΔG> 0). Následující obrázek dále shrnuje, co bylo právě vysvětleno:
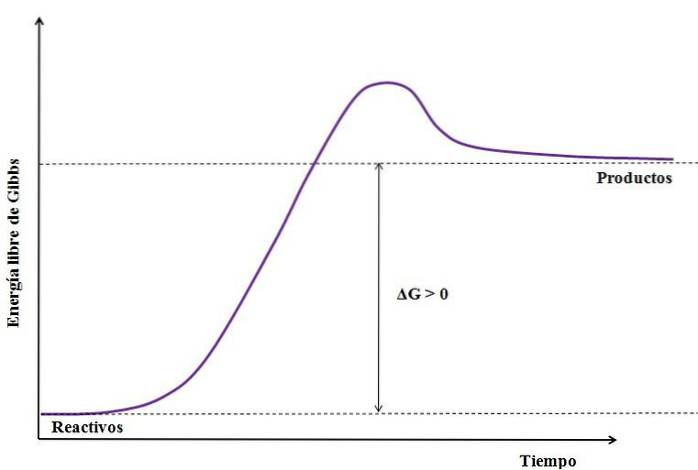
Všimněte si rozdílu mezi energetickými stavy mezi produkty a reaktanty (fialová čára). Reaktanty se proto nestávají produkty (A + B => C), pokud nedojde k první absorpci tepla..
Zvyšuje volnou energii systému
Každá endergonická reakce je spojena se zvýšením Gibbsovy volné energie systému. Pokud je pro určitou reakci splněno, že ΔG> 0, pak to nebude spontánní a bude nutné provést dodávku energie.
Jak matematicky vědět, zda je reakce endergonická nebo ne? Použití následující rovnice:
ΔG = ΔH-TΔS
Kde ΔH je entalpie reakce, tj. Celková uvolněná nebo absorbovaná energie; ΔS je změna entropie a T je teplota. Faktor TΔS je ztráta energie nepoužívaná při expanzi nebo uspořádání molekul ve fázi (pevná látka, kapalina nebo plyn).
ΔG je tedy energie, kterou může systém použít k práci. Protože ΔG má kladné znaménko pro endergonickou reakci, musí být do systému (reaktantů) aplikována energie nebo práce za účelem získání produktů.
Poté, když známe hodnoty ΔH (pozitivní, pro endotermickou reakci a negativní, pro exotermní reakci), a TΔS, je možné vědět, zda je reakce endergonická. To znamená, že i když je reakce endotermická, ne je nutně endergonický.
Kostka ledu
Například kostka ledu se roztaví na kapalnou vodu a absorbuje teplo, což pomáhá oddělit její molekuly; proces je však spontánní, a proto nejde o endergonickou reakci.
A co situace, kdy chcete roztát led při teplotě hluboko pod -100 ° C? V tomto případě bude termín TΔS v rovnici volné energie malý ve srovnání s ΔH (protože T klesá) a ve výsledku bude mít ΔG kladnou hodnotu.
Jinými slovy: tání ledu pod -100 ° C je endergonický proces a není to spontánní. Podobným případem je zmrazení vody kolem 50 ° C, k čemuž nedochází spontánně..
Odkazy na vaše produkty jsou slabší
Další důležitou charakteristikou, také související s ΔG, je energie nových vazeb. Vazby vzniklých produktů jsou slabší než vazby reaktantů. Pokles pevnosti vazeb je však kompenzován přírůstkem hmotnosti, který se odráží ve fyzikálních vlastnostech.
Zde srovnání se zděnou zdí začíná ztrácet smysl. Podle výše uvedeného musí být vazby uvnitř cihel silnější než vazby mezi nimi a cementem. Stěna jako celek je však díky své větší hmotnosti pevnější a odolnější..
Něco podobného bude vysvětleno v sekci příkladů, ale s cukrem.
Je spojen s exergonickými reakcemi
Pokud endergonické reakce nejsou spontánní, jak probíhají v přírodě? Odpověď je dána spojením s jinými reakcemi, které jsou zcela spontánní (exergonické) a které nějakým způsobem podporují jejich vývoj..
Například následující chemická rovnice představuje tento bod:
A + B => C (endergonická reakce)
C + D => E (exergonická reakce)
První reakce není spontánní, takže k ní přirozeně nemohlo dojít. Produkce C však umožňuje, aby došlo k druhé reakci, která způsobí E.
Přidáním Gibbsových volných energií pro dvě reakce, ΔG1 a AGdva, s výsledkem menším než nula (ΔG<0), entonces el sistema presentará un incremento de la entropía y por lo tanto será espontáneo.
Pokud by C nereagoval s D, A by to nikdy nezformoval, protože neexistuje žádná energetická kompenzace (jako v případě peněz s cihlovou zdí). Pak se říká, že C a D „přitahují“ A a B k reakci, i když se jedná o endergonickou reakci..
Příklady

Fotosyntéza
Rostliny využívají sluneční energii k výrobě sacharidů a kyslíku z oxidu uhličitého a vody. COdva mědva, malé molekuly se silnými vazbami, tvoří cukry s kruhovými strukturami, které jsou těžší, pevnější a tají se při teplotě kolem 186 ° C..
Všimněte si, že vazby C-C, C-H a CO jsou slabší než vazby O = C = O a O = O. A z cukrové jednotky může rostlina syntetizovat polysacharidy, jako je celulóza.
Syntéza biomolekul a makromolekul
Endergonické reakce jsou součástí anabolických procesů. Stejně jako uhlohydráty vyžadují i jiné biomolekuly, jako jsou bílkoviny a lipidy, složité mechanismy, které by bez nich a spojení s hydrolýzou ATP nemohly existovat.
Podobně jsou příklady endergonických reakcí metabolické procesy, jako je buněčné dýchání, difúze iontů buněčnými membránami a transport kyslíku krevním řečištěm..
Tvorba diamantů a těžkých sloučenin z ropy
Diamanty vyžadují enormní tlaky a teploty, aby bylo možné jejich součásti zhutnit do krystalické pevné látky..
Některé krystalizace jsou však spontánní, i když k nim dochází velmi nízkou rychlostí (spontánnost nemá žádný vztah k kinetice reakce).
A konečně, samotná ropa představuje produkt endergonických reakcí, zejména těžkých uhlovodíků nebo makromolekul nazývaných asfaltény..
Jejich struktury jsou velmi složité a jejich syntéza trvá dlouhou dobu (miliony let), působení tepla a bakterií..
Reference
- QuimiTube. (2014). Endergonické a exergonické reakce. Obnoveno z: quimitube.com
- Khan Academy. (2018). Energie zdarma. Obnoveno z: es.khanacademy.org
- Biologický slovník. (2017). Definice endergonické reakce. Obnoveno z: biologydictionary.net
- Lougee, Mary. (18. května 2018). Co je to endergonická reakce? Vědění. Obnoveno z: sciencing.com
- Helmenstine, Anne Marie, Ph.D. (22. června 2018). Endergonic vs. Exergonic (s příklady). Obnoveno z: thoughtco.com
- Arrington D. (2018). Endergonická reakce: definice a příklady. Studie. Obnoveno z: study.com
- Audersirk Byers. (2009). Život na Zemi. Co je to energie? [PDF]. Obnoveno z: hhh.gavilan.edu



Zatím žádné komentáře