
Charakteristické chemické reakce, části, typy, příklady

The chemické reakce Jsou to změny, kterým hmota prochází v uspořádání svých atomů, a dochází k nim při kontaktu dvou různých látek nebo sloučenin. Změny pocházejí z procesu, který lze okamžitě vidět; jako je zvýšení teploty, chlazení, tvorba plynu, blikání nebo srážení pevné látky.
Nejběžnější chemické reakce si v každodenním životě často nevšimnou; tisíce z nich jsou prováděny v našich tělech. Jiné jsou však viditelnější, protože je můžeme vyrobit v kuchyni výběrem správného nádobí a surovin; například smíchání jedlé sody s octem, rozpuštění cukru ve vodě nebo okyselení fialové zelné šťávy.

V laboratořích se chemické reakce stávají běžnějšími a běžnějšími; všechny se vyskytují v kádinkách nebo Erlenmeyerových baňkách. Pokud sdílejí něco společného, pak je to tak, že žádný z nich není jednoduchý, protože skrývají kolize, přerušení spojení, mechanismy, vytváření spojení, energetické a kinetické aspekty..
Existují chemické reakce tak nápadné, že amatéři a vědci, kteří znají toxikologii činidel a některá bezpečnostní opatření, je reprodukují ve velkém měřítku ve fascinujících demonstračních událostech..
Rejstřík článků
- 1 Pojem chemické reakce
- 2 Charakteristiky chemických reakcí
- 2.1 Kinetika
- 2.2 Konzervování těsta
- 2.3 Fyzické změny a / nebo změny stavu
- 2.4 Barevné variace
- 2.5 Uvolňování plynů
- 2.6 Změny teploty
- 3 Části chemické reakce
- 3.1 Činidla a produkty
- 3.2 Reakční médium
- 3.3 Plavidla nebo reaktory
- 4 Druhy chemických reakcí
- 4.1 - Redukce oxidace (redox)
- 4.2 - Syntéza
- 4.3 - Rozklad
- 4.4 - Zdvihový objem
- 4.5 - Tvorba plynu
- 4.6 - Metatéza nebo dvojité posunutí
- 5 Příklady chemických reakcí
- 5.1 Rolování
- 5.2 Neutralizace
- 5.3 Dvojité posouvání
- 5.4 Redox
- 6 Cvičení vyřešených chemických reakcí
- 6.1 - Cvičení 1
- 6.2 - Cvičení 2
- 6.3 - Cvičení 3
- 7 Reference
Koncept chemické reakce
Chemické reakce probíhají, když dojde k rozbití vazby (iontové nebo kovalentní), takže se na jejím místě vytvoří další; dva atomy nebo jejich sada přestanou silně interagovat, aby vytvořily nové molekuly. Díky tomu lze určit chemické vlastnosti sloučeniny, její reaktivitu, stabilitu a to, na co reaguje.
Kromě toho, že jsou zodpovědní za chemické reakce, které hmota neustále transformuje, aniž by to ovlivnilo její atomy, vysvětlují vznik sloučenin, jak je známe..
Energie je potřebná k rozbití vazeb, a když se vytvoří vazby, uvolní se. Pokud je absorbovaná energie větší než uvolněná, říká se, že reakce je endotermická; máme ochlazení okolí. Vzhledem k tomu, že pokud je uvolněné teplo vyšší než absorbované, bude se jednat o exotermickou reakci; okolí se zahřívá.
Charakteristiky chemických reakcí

Kinetika
Molekuly se teoreticky musí navzájem srazit a nést s sebou dostatek kinetické energie na podporu rozbití vazby. Pokud jsou jejich srážky pomalé nebo neúčinné, je chemická reakce ovlivněna kineticky. K tomu může dojít buď podle fyzikálních stavů látek, nebo podle jejich geometrie či struktury..
Při reakci se tedy hmota transformuje absorbováním nebo uvolňováním tepla a současně prochází srážkami, které upřednostňují tvorbu produktů; nejdůležitější složky jakékoli chemické reakce.
Konzervování těsta
Kvůli zákonu zachování hmoty zůstává celková hmotnost sestavy po chemické reakci konstantní. Součet jednotlivých hmotností každé látky se tedy rovná hmotnosti získaného výsledku.
Fyzické změny a / nebo změny stavu
Výskyt chemické reakce může být doprovázen změnou stavu složek; tj. změna v pevném, kapalném nebo plynném stavu materiálu.
Ne všechny změny stavu však zahrnují chemickou reakci. Například: pokud se voda odpařuje působením tepla, vodní pára produkovaná po této změně stavu je stále voda.
Barevné variace
Mezi fyzikálními vlastnostmi, které jsou výsledkem chemické reakce, vyniká změna barvy reagencií oproti barvě konečného produktu..
Tento jev je patrný při pozorování chemické reakce kovů s kyslíkem: když kov oxiduje, mění svou charakteristickou barvu (případně zlato nebo stříbro), aby změnil červeno-oranžový odstín, známý jako rez..
Uvolňování plynů
Tato vlastnost se projevuje jako probublávání nebo emise určitých pachů.
Bubliny se obecně objevují jako důsledek vystavení kapaliny vysokým teplotám, což podněcuje zvýšení kinetické energie molekul, které jsou součástí reakce..
Změny teploty
V případě, že je teplo katalyzátorem chemické reakce, bude v konečném produktu vyvolána změna teploty. Proto může být vstup a výstup tepla v procesu také charakteristikou chemických reakcí..
Části chemické reakce
Činidla a produkty
Jakákoli chemická reakce je reprezentována rovnicí typu:
A + B → C + D
Kde A a B jsou reaktanty, zatímco C a D jsou produkty. Rovnice nám říká, že atom nebo molekula A reaguje s B za vzniku produktů C a D. Toto je nevratná reakce, protože reaktanty nemohou z produktů znovu pocházet. Na druhou stranu je reakce níže reverzibilní:
A + B <=> C + D
Je důležité zdůraznit, že hmotnost reaktantů (A + B) se musí rovnat hmotnosti produktů (C + D). Jinak by se těsto nezachovalo. Podobně musí být počet atomů pro daný prvek stejný před šipkou i za ní.
Nad šipkou jsou uvedeny některé specifické specifikace reakce: teplota (Δ), výskyt ultrafialového záření (hv), nebo použitý katalyzátor.
Reakční média
Pokud jde o život a reakce, ke kterým dochází v našem těle, je reakčním prostředím voda (ac). Chemické reakce však mohou probíhat v jakémkoli kapalném médiu (ethanol, ledová kyselina octová, toluen, tetrahydrofuran atd.), Pokud jsou činidla dobře rozpuštěna..
Plavidla nebo reaktory
Řízené chemické reakce probíhají v nádobě, buď v jednoduchém skle, nebo v reaktoru z nerezové oceli.
Druhy chemických reakcí
Typy chemických reakcí jsou založeny na tom, co se děje na molekulární úrovni; jaké vazby jsou přerušeny a jak se atomy nakonec spojí. Rovněž se bere v úvahu, zda druh získává nebo ztrácí elektrony; i když ve většině chemických reakcí k tomu dochází.
Zde vysvětlíme různé typy chemických reakcí, které existují.
- Oxidačně-redukční (redox)
Oxidace mědi
V příkladu patiny probíhá oxidační reakce: kovová měď ztrácí elektrony v přítomnosti kyslíku, aby se transformovala na odpovídající oxid.
4Cu (s) + O.dva(g) => CudvaVy)
Oxid měďnatý nadále oxiduje na oxid měďnatý:
2 CudvaO (s) + Odva => 4CuO (s)
Tento typ chemické reakce, při které druh zvyšuje nebo snižuje svůj počet (nebo stav) oxidace, je známý jako oxidační a redukční (redoxní) reakce..
Kovová měď s oxidačním stavem 0 nejprve ztrácí jeden elektron a poté druhý (oxiduje), zatímco kyslík zůstává (redukuje):
Cu => Cu+ + a-
Cu+ => Cudva+ + a-
NEBOdva + 2e- => 2Odva-
Zisk nebo ztrátu elektronů lze určit výpočtem oxidačních čísel atomů v chemických vzorcích jejich výsledných sloučenin..
Pro CudvaNebo je známo, že protože je to oxid, máme anion Odva-, Proto, aby byly náboje neutralizovány, musí mít každý ze dvou atomů mědi náboj +1. Velmi podobné se děje s CuO.
Když měď oxiduje, získává kladná oxidační čísla; a kyslík, který má být snížen, negativní oxidační čísla.
Železo a kobalt
Další příklady redoxních reakcí jsou uvedeny níže. Rovněž bude učiněn krátký komentář a budou specifikovány změny v oxidačních číslech..
FeCldva + CoCl3 => FeCl3 + CoCldva
Pokud se počítají oxidační čísla, je třeba poznamenat, že čísla Cl zůstávají s konstantní hodnotou -1; ne jako to, s těmi z Fe y Co..
Na první pohled bylo železo oxidováno, zatímco kobalt snížen. Jak to víš? Protože železo nyní neinteraguje se dvěma Cl anionty- ale se třemi atomy chloru (neutrální) jsou více elektronegativní než železo a kobalt. Na druhé straně se kobalt stává opačným: jde o interakci se třemi Cl- dva z nich.
Pokud výše uvedená úvaha není jasná, pokračujeme v psaní chemických rovnic čistého přenosu elektronů:
Víradva+ => Víra3+ + a-
Spol3+ + a- => Codva+
Proto Fedva+ rez, zatímco Co3+ je snížena.
Jód a mangan
6KMnO4 + 5KI + 18HCI => 6MnCldva + 5KIO3 + 6 KCl + 9 HdvaNEBO
Chemická rovnice výše se může zdát komplikovaná, ale není. Chlor (Cl-) nebo kyslík (O.dva-) zkušenosti se ziskem nebo ztrátou jejich elektronů. Jód a mangan, jo.
Vezmeme-li v úvahu pouze sloučeniny s jódem a manganem, máme:
KI => KIO3 (oxidační číslo: -1 až +5, ztratit šest elektronů)
KMnO4 => MnCldva (oxidační číslo: +7 až +2, zisk pěti elektronů)
Jód se oxiduje, zatímco mangan se redukuje. Jak to zjistit bez výpočtů? Protože jód přechází z draslíku na interakci se třemi kyslíky (více elektronegativní); a mangan sám o sobě ztrácí interakce s kyslíkem, aby byl s chlorem (méně elektronegativní).
KI nemůže ztratit šest elektronů, pokud KMnO4 vyhrát pět; proto musí být počet elektronů vyvážen v rovnici:
5 (KI => KIO3 + 6e-)
6 (KMnO4 + 5e- => MnCldva)
Což má za následek čistý přenos 30 elektronů.
Spalování
Spalování je energická a energetická oxidace, při které se uvolňuje světlo a teplo. Obecně se na tomto typu chemické reakce podílí kyslík jako oxidační nebo oxidační činidlo; zatímco redukčním činidlem je palivo, které na konci dne spaluje.
Tam, kde je popel, došlo ke spalování. Ty jsou v zásadě složeny z uhlíku a oxidů kovů; i když jeho složení logicky závisí na tom, o jaké palivo šlo. Níže uvádíme několik příkladů:
C (s) + O.dva(g) => COdva(G)
2CO (g) + Odva(g) => 2COdva(G)
C3H8(g) +50dva(g) => 3COdva(g) + 4HdvaO (g)
Každá z těchto rovnic odpovídá úplnému spalování; to znamená, že veškeré palivo reaguje s přebytkem kyslíku, aby byla zajištěna jeho úplná transformace.
Rovněž je třeba poznamenat, že COdva a HdvaNebo jsou hlavními produkty plynné při hoření uhlíkatých těl (jako je dřevo, uhlovodíky a zvířecí tkáně). Je nevyhnutelné, že v důsledku nedostatku kyslíku a méně okysličených plynů, jako jsou CO a NO, vzniká určitý uhlíkový allotrope.
- Syntéza
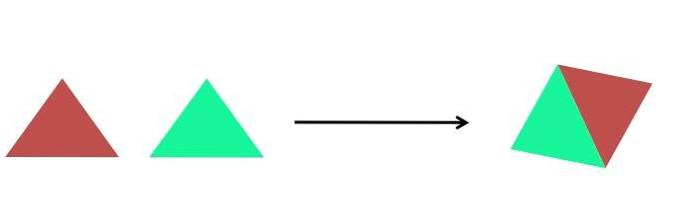
Obrázek výše ukazuje extrémně jednoduchou reprezentaci. Každý trojúhelník je sloučenina nebo atom, které se spojí a vytvoří jednu sloučeninu; dva trojúhelníky tvoří rovnoběžník. Zvyšují se hmotnosti a fyzikální a chemické vlastnosti produktu se mnohokrát velmi liší od vlastností jeho činidel.
Například spalováním vodíku (což je také redoxní reakce) vzniká oxid vodíku nebo hydrid kyslíku; lépe známý jako voda:
Hdva(g) + O.dva(g) => 2HdvaO (g)
Když jsou dva plyny smíchány, při vysoké teplotě hoří a produkují plynnou vodu. Jak teploty chladnou, páry kondenzují za vzniku kapalné vody. Několik autorů považuje tuto syntézu za jednu z možných alternativ k nahrazení fosilních paliv při získávání energie.
Vazby H-H a O = O se rozpadají a vytvářejí dvě nové jednoduché vazby: H-O-H. Voda, jak je dobře známo, je jedinečnou látkou (mimo romantický význam) a její vlastnosti se zcela liší od plynného vodíku a kyslíku..
Iontové sloučeniny
Tvorba iontových sloučenin z jejich prvků je také příkladem syntézní reakce. Jedním z nejjednodušších je tvorba halogenidů kovů skupin 1 a 2. Například syntéza bromidu vápenatého:
Ca (s) + Brdva(l) => CaBrdva(s)
Obecná rovnice pro tento typ syntézy je:
M (s) + Xdva => MXdva(s)
Koordinace
Když vzniklá sloučenina zahrnuje atom kovu v elektronické geometrii, říká se, že jde o komplex. V komplexech zůstávají kovy připojeny k ligandům slabými kovalentními vazbami a jsou tvořeny koordinačními reakcemi.
Například máme komplex [Cr (NH3)6]3+. Tvoří se, když kation Cr3+ je v přítomnosti molekul amoniaku, NH3, které působí jako chromové ligandy:
Cr3+ + 6NH3 => [Cr (NH3)6]3+
Výsledný koordinační osmistěn kolem středu kovového chromu je uveden níže:
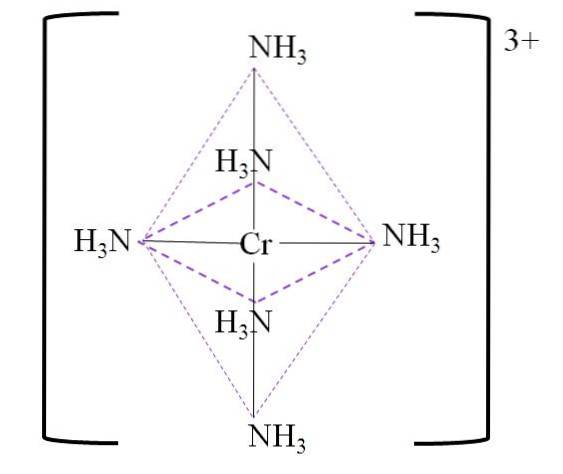
Všimněte si, že náboj 3+ na chromu není v komplexu neutralizován. Jeho barva je fialová, a proto je osmistěn představován touto barvou.
Některé komplexy jsou zajímavější, jako v případě určitých enzymů, které koordinují atomy železa, zinku a vápníku.
- Rozklad
Rozklad je opakem syntézy: sloučenina se rozkládá na jeden, dva nebo tři prvky nebo sloučeniny.
Máme například následující tři rozklady:
2HgO (s) => 2Hg (l) + Odva(G)
2HdvaNEBOdva(l) => 2HdvaO (l) + Odva(G)
HdvaCO3(ac) => COdva(g) + HdvaO (l)
HgO je načervenalá pevná látka, která se působením tepla rozkládá na kovovou rtuť, černou kapalinu a kyslík..
Peroxid vodíku nebo peroxid vodíku podléhá rozkladu a poskytuje kapalnou vodu a kyslík.
A kyselina uhličitá se zase rozkládá na oxid uhličitý a kapalnou vodu.
„Sušším“ rozkladem je rozklad uhličitanů kovů:
Zloděj3(s) => CaO (s) + COdva(G)
Třída sopky

Rozkladovou reakcí, která se používá na hodinách chemie, je tepelný rozklad dichromanu amonného (NH4)dvaCrdvaNEBO7. Tato karcinogenní oranžová sůl (takže s ní musíte zacházet velmi opatrně), hoří, aby uvolnila velké množství tepla a vytvořila zelenou pevnou látku, oxid chromitý, CrdvaNEBO3:
(NH4)dvaCrdvaNEBO7(s) => CrdvaNEBO3(s) + 4HdvaO (g) + Ndva(G)
- Přemístění
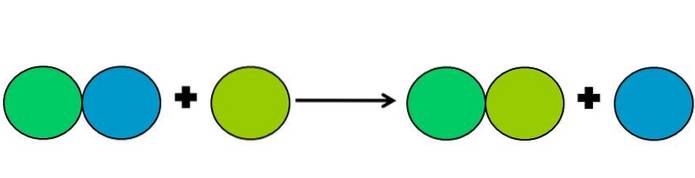
Vytěsňovací reakce jsou typem redoxní reakce, při které jeden prvek vytěsňuje jiný ve sloučenině. Posunutý prvek končí snižováním nebo získáváním elektronů.
Pro zjednodušení výše uvedeného je zobrazen obrázek výše. Kruhy představují prvek. Je pozorováno, že limetkově zelený kruh přemisťuje modrý, zbývající na vnější straně; ale nejen to, ale modrý kruh se během procesu zmenšuje a vápno zelený rez.
Vodíku
Máme například následující chemické rovnice, které vysvětlují výše uvedené:
2 Al (s) + 6HCl (aq) => AlCl3(aq) + 3Hdva(G)
Zr (s) + 2HdvaO (g) => ZrOdva(s) + 2Hdva(G)
Zn (s) + HdvaSW4(ac) => ZnSO4(ac) + Hdva(G)
Jaký je přemístěný prvek pro tyto tři chemické reakce? Vodík, který se redukuje na molekulární vodík, Hdva; přechází z oxidačního čísla +1 na 0. Pamatujte, že kovy hliník, zirkonium a zinek mohou vytlačit vodíky kyselin a vody; zatímco měď, ani stříbro, ani zlato, nemohou.
Kovů a halogenů
Podobně existují tyto dvě další reakce posunutí:
Zn (y) + CuSO4(ac) => Cu (s) + ZnSO4(ac)
Cldva(g) + 2NaI (aq) => 2NaCl (aq) + Idva(s)
V první reakci vytěsňuje zinek méně aktivní kovovou měď; zinek je oxidován, zatímco měď je redukována.
Ve druhé reakci naopak chlor, prvek reaktivnější než jód, vytěsňuje tento prvek v sodné soli. Tady je to naopak: nejreaktivnější prvek se sníží oxidací vytlačeného prvku; chlor se proto redukuje oxidací jodu.
- Tvorba plynu
V reakcích bylo vidět, že několik z nich generovalo plyny, a proto také vstupují do tohoto typu chemické reakce. Podobně se reakce předchozí části, reakce vodíku na aktivní kov, považují za reakce tvorby plynu..
Kromě již zmíněných, sirníky kovů například uvolňují sirovodík (který voní jako shnilá vejce), když se přidá kyselina chlorovodíková:
NadvaS (s) + 2HCl (aq) => 2NaCl (aq) + HdvaS (g)
- Metatéza nebo dvojité posunutí
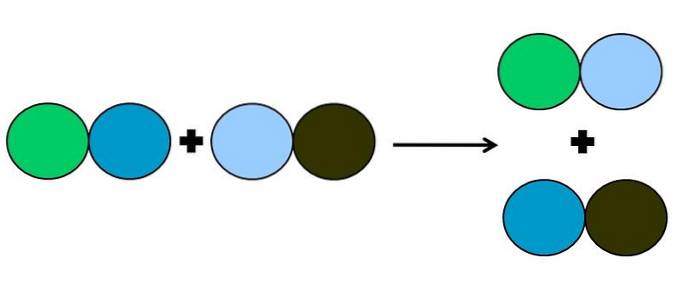
V metatezi nebo reakci s dvojitým posunem nastává změna partnerů bez elektronových přenosů; to znamená, že se nepovažuje za redoxní reakci. Jak je vidět na obrázku výše, zelený kruh přeruší spojení s tmavě modrým kruhem, aby se propojil se světle modrým kruhem.
Srážky
Když jsou interakce jednoho z partnerů dostatečně silné, aby překonaly solvatační účinek kapaliny, získá se sraženina. Následující chemické rovnice představují srážecí reakce:
AgNO3(aq) + NaCl (aq) => AgCl (s) + NaNO3(ac)
CaCldva(ac) + NadvaCO3(ac) => CaCO3(s) + 2NaCl (vod.)
V první reakci Cl- přesouvá na NO3- za vzniku chloridu stříbrného, AgCl, což je bílá sraženina. A ve druhé reakci CO3dva- přesouvá do Cl- k vysrážení uhličitanu vápenatého.
Zásaditá kyselina
Pravděpodobně nejtypičtější z reakcí metathézy je acidobazická neutralizace. Na závěr jsou jako příklady uvedeny dvě acidobazické reakce:
HCl (vodný) + NaOH (vodný) => NaCl (vodný) + HdvaO (l)
2HCl (aq) + Ba (OH)dva(ac) => BaCldva(aq) + 2HdvaO (l)
OH- přemístit Cl- za vzniku vody a chloridových solí.
Příklady chemických reakcí
Níže a níže budou zmíněny některé chemické reakce s příslušnými rovnicemi a komentáři..
Přemístění
Zn (s) + AgNO3(ac) → 2Ag (s) + Zn (Č3)dva(ac)
Zinek vytěsňuje stříbro v jeho dusičnanové soli: snižuje jej z Ag+ Výsledkem je, že se v médiu začne srážet kovové stříbro, pozorované pod mikroskopem jako stříbřité stromy bez listí. Na druhé straně se dusičnan kombinuje s ionty Zndva+ což vede k tvorbě dusičnanu zinečnatého.
Neutralizace
Zloděj3(s) + 2HCl (vodný) → CaCldva(ac) + HdvaO (l) + COdva(G)
Kyselina chlorovodíková neutralizuje uhličitan vápenatý sůl za vzniku soli, chloridu vápenatého, vody a oxidu uhličitého. COdva bublá a je detekován ve vodě. Toto probublávání se také získá přidáním HCl do křídy nebo vaječných skořápek bohatých na CaCO3.
NH3(g) + HCl (g) → NH4Cl (s)
V této druhé reakci páry HCl neutralizují plynný amoniak. Chlorid amonný, NH4Cl, je vytvořen jako bělavý kouř (spodní obrázek), protože obsahuje velmi jemné částice suspendované ve vzduchu.

Dvojitý svitek
AgNO3(aq) + NaCl (aq) → AgCl (s) + NaNO3(ac)
Při reakci dvojitého vysídlení dochází k výměně „partnerů“. Stříbro mění partnery se sodíkem. Výsledkem je, že nová sůl, chlorid stříbrný, AgCl, se vysráží jako mléčná pevná látka..
Redox

Existuje nespočet redoxních reakcí. Jedním z nejpůsobivějších je Barkin Dog:
8 NdvaO (g) + 4 CSdva(l) → S.8s + 4 COdva(g) + 8 N.dva(G)
Energie uvolněná při tvorbě tří stabilních produktů je natolik, že dochází k namodralému záblesku (horní obrázek) a výraznému zvýšení tlaku způsobeného vznikajícími plyny (COdva a Ndva).
A navíc to vše doprovází velmi hlasitý zvuk podobný štěkání psa. Produkovaná síra, S8, pokryje vnitřní stěny tuby žlutě.
Který druh je redukován a který je oxidován? Obecně platí, že prvky mají oxidační číslo 0. Proto musí být síra a dusík v produktech druh, který získal nebo ztratil elektrony..
Síra oxidovala (ztracené elektrony), protože měla oxidační číslo -2 v CSdva (C4+Sdvadva-):
Sdva- → S.0 + 2e-
Zatímco dusík byl redukován (získané elektrony), protože měl oxidační číslo +1 v dusíkudvaO (Ndva+NEBOdva-):
2N+ + 2e → N0
Řešení řešených chemických reakcí
- Cvičení 1
Jaká sůl se vysráží v následující reakci ve vodném prostředí?
NadvaS (ac) + FeSO4(ac) → ¿?
Obecně platí, že všechny sulfidy, s výjimkou těch, které se tvoří s alkalickými kovy a amoniem, se vysráží ve vodném prostředí. Dochází k dvojitému posunutí: železo se váže na síru a sodík na síran:
NadvaS (ac) + FeSO4(ac) → FeS (s) + NadvaSW4(ac)
- Cvičení 2
Jaké produkty získáme z následující reakce?
Razítko3)dva + Ca (OH)dva →?
Hydroxid vápenatý není ve vodě příliš rozpustný; ale přidání dusičnanu měďnatého ho pomáhá solubilizovat, protože reaguje za vzniku odpovídajícího hydroxidu:
Razítko3)dva(ac) + Ca (OH)dva(ac) → Cu (OH)dva(s) + Ca (Č3)dva(ac)
Cu (OH)dva okamžitě rozpoznatelné jako modrá sraženina.
- Cvičení 3
Jaká sůl se bude vyrábět v následující neutralizační reakci?
Al (OH)3(s) + 3HCl (vod.) → ¿?
Hydroxid hlinitý se chová jako báze reagující s kyselinou chlorovodíkovou. Při acidobazické neutralizační reakci (Bronsted-Lowry) se vždy tvoří voda, takže dalším produktem musí být chlorid hlinitý, AlCl3:
Al (OH)3(s) + 3HCl (vodný) → AlCl3(aq) + 3HdvaNEBO
Tentokrát AlCl3 se nevysráží, protože je to sůl (do určité míry) rozpustná ve vodě.
Reference
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Ana Zita. (18. listopadu 2019). Chemické reakce. Obnoveno z: todamateria.com
- Kashyap Vyas. (23. ledna 2018). 19 skvělých chemických reakcí, které dokazují, že věda je fascinující. Obnoveno z: interestingengineering.com
- BeautifulChemistry.net (s.f.). Reakce. Obnoveno z: beautifulchemistry.net
- Wikipedia. (2019). Chemická reakce. Obnoveno z: en.wikipedia.org

Zatím žádné komentáře