
Spektrální série
The spektrální série Skládají se ze sady barevných čar na tmavém pozadí nebo ze světlých pruhů oddělených tmavými oblastmi, které vyzařují světlo ze všech druhů látek..
Tyto čáry jsou vizualizovány pomocí spektrometru, aparátu, který se skládá z hranolu nebo jemně rozdělené mřížky, schopné oddělit různé složky světla..
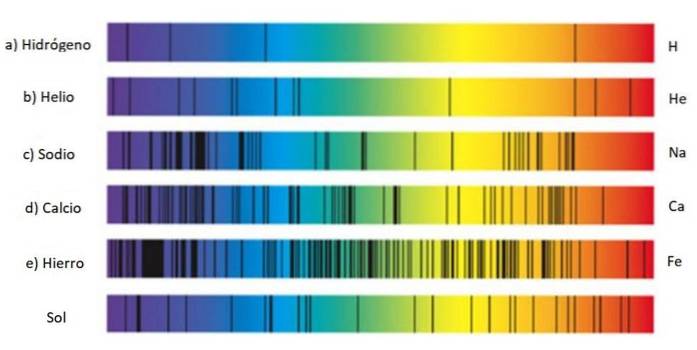
Tyto sady řádků se nazývají spektrum a každá látka má charakteristické spektrum, druh otisku prstu, který slouží k identifikaci její přítomnosti ve světle, které pochází z objektu. Je to proto, že každý atom má svou vlastní konfiguraci elektronů a povolené úrovně energie..
To je důvod, proč hledání spektrálních čar je technika široce používaná astronomy k zjišťování složení hvězd prostřednictvím světla, které emitují. Ve skutečnosti vše, co astronomové vědí o hvězdách, pochází z jejich spekter, ať už jde o emise nebo absorpci..
Původ spekter
Přítomnost spekter je způsobena atomovou konfigurací. Ve skutečnosti jsou elektrony drženy kolem jádra v oblastech zvaných orbitaly, nachází se v diskrétních vzdálenostech od něj.
Například ve vodíku, nejjednodušším prvku, jsou orbitální poloměry dány 0,053 ∙ ndva nanometry, kde n = 1, 2, 3, 4,…. Mezilehlé hodnoty mezi nimi nejsou povoleny, proto se říká, že orbitaly jsou kvantováno. Rovněž je kvantován energetický stav každého orbitálu.
Taková omezení způsobují, že se elektrony chovají jak jako částice, tak také jako vlny, stejně jako světlo. Elektrony však mohou přecházet z jedné orbity na druhou a měnit energetický stav atomu..
Absorpce a emise elektromagnetické energie
Například pokud elektron přechází z více vnitřního orbitálu s nižší energií na vnější a energičtější, je nutné, aby získal potřebnou elektromagnetickou energii, která je uložena v atomu. Tento proces se nazývá vstřebávání.
Na druhou stranu, pokud elektron přechází z vnější oběžné dráhy do vnitřní, je při přechodu emitován foton ve formě světla, což je energie odpovídající rozdílu v energii mezi orbitaly. Vlnová délka odpovídá tomuto rozdílu a je dána vztahem:

- E je energie
- λ je vlnová délka
- h je Planckova konstanta
- c je rychlost světla
Druhy spekter
Vytváří se absorpční i emisní spektra, která závisí na určitých parametrech objektu nebo látky, jako je hustota a teplota. Spektrum tenkého plynu se liší od spektra pevné látky při vysoké teplotě.
Kontinuální spektrum
Některé zdroje vyzařují spektra, jejichž barevné čáry se plynule mění a obsahují všechny barvy. Tomu se říká spojité spektrum, například spektrum produkované vláknem žárovky.
Emisní spektrum
Je to ten, který vyzařují určité horké látky a skládá se z několika řádků určité vlnové délky.
Tento typ spektra je produkován horkými tenkými plyny, jako jsou ty, které naplňují zářivky. Polární záře je dalším příkladem emise, ke které dochází v plynech v horní atmosféře Země. Některé mezihvězdné oblaky plynu také produkují emisní spektra..
Absorpční spektrum
Toto spektrum je přijímáno, když světlo z velmi horkého a hustého předmětu prochází chladnějším plynem. V něm jsou pozorovány téměř všechny barvy, ale některé vypadají zmenšené a tmavé třásně se objevují v těch vlnových délkách, které jsou absorbovány atomy nebo molekulami plynu..
Kirchoffovy zákony spektroskopie
Kirchoffovy zákony spektroskopie naznačují, za jakých podmínek vznikají různá výše popsaná spektra:
- Kontinuální spektra: jsou emitována jakýmkoli objektem při vysokém tlaku a teplotě.
- Emisní spektra: jsou vytvářena horkým plynem při nízkém tlaku, který emituje čáry v přesně definovaných vlnových délkách, odpovídajících elektronickým přechodům odpovídajícím každému prvku, který tvoří plyn.
- Absorpční spektra: jsou vytvářena plyny při nízkých teplotách umístěných v blízkosti zdrojů nepřetržitého záření. Atomy nebo molekuly plynu absorbují pouze určité vlnové délky.
Emisní spektrum vodíku
Zvláště důležité je emisní spektrum vodíku, protože je to nejhojnější prvek v celém vesmíru a obsahuje mnoho důležitých informací o hvězdách a Mléčné dráze..
Řadu čar ve vodíkovém spektru objevili různí vědci a každá z nich nese jeho jméno.
Série Balmer
Vodík emituje několik linek ve viditelném spektru: když se elektron rozpadne z oběžné dráhy 3 na oběžnou dráhu 2, vyzařuje červené světlo, jehož vlnová délka je 656,6 nm, a pokud se rozpadá z oběžné dráhy 4 na oběžnou dráhu 2, vyzařuje modré světlo 486,1 nm.

V roce 1885 (předtím, než Bohr navrhl svou teorii) našel švýcarský matematik a profesor Johann Balmer (1825-1898) metodou pokusu a omylu vzorec pro určení vlnových délek λ těchto linií:

Kde:
- R je Rydbergova konstanta: 1,097 × 107 m-1
- n = 3, 4, 5…., tj. n ≥ 3 (celé číslo).
Například pro n = 3 v Balmerově rovnici:

Odpovídá červené čáře vpravo zobrazené na obrázku výše. Objev řady Balmer vedl další vědce k hledání linek ve zbytku spektra pro vodík a další plyny..
Lyman série
Všimněte si, že spektrum vodíku zobrazené na obrázku obsahuje ultrafialové čáry, dvě zcela vlevo, jejichž vlnové délky jsou 397,0 nm a 388,9 nm. nm.
Tyto ultrafialové čáry skutečně odpovídají takzvané Lymanově sérii, kterou objevil v roce 1906 fyzik Theodore Lyman. Jeho vzorec je:

Paschen série
Paschenova řada byla objevena německým fyzikem Friederichem Paschenem v roce 1908 a je platná pro n ≥ 4, tedy: n = 4, 5, 6 ...

Paschenovy čáry jsou v blízké infračervené oblasti a konečná úroveň je n = 3, to znamená, že jejich hodnoty nastávají, když se elektron rozpadne z vyšších úrovní na n = 3. Jelikož je Lymanova řada v ultrafialovém záření, dochází k závěrům že Balmerova série leží mezi Lymanem a Paschenem.
Řada Brackett
Tato série, objevená v roce 1922 americkým fyzikem Frederickem Brackettem, se nachází ve vzdálené infračervené oblasti a skládá se ze spektrálních čar odpovídajících přechodům vodíku začínajícím na n = 5 a pokračujících:

Série Pfund
Série Pfund byla nalezena v roce 1924 severoamerickým fyzikem Augustem Hermannem Pfundem a odkazuje na přechody, které začínají n = 5, v daleko infračerveném pásmu:

- Arny, T. 2017. Explorations: An Introduction to Astronomy. 8. Ed. McGraw Hill.
- Bauer, W. 2011. Fyzika pro inženýrství a vědy. Svazek 2. Mc Graw Hill.
- Chang, R. 2013. Chemistry. 11. Edice. Mc Graw Hill Education.
- Sears, Zemansky. 2016. Univerzitní fyzika s moderní fyzikou. 14. Vyd. 2. díl Pearson.
- Okna otevřená vesmíru. Různé třídy spektra. Obnoveno z: media4.obspm.fr.



Zatím žádné komentáře