
Struktura krystalických pevných látek, vlastnosti, typy, příklady

The krystalické pevné látky Jsou to ti, jejichž mikroskopické struktury jsou uspořádány a podléhají charakteristickému vzoru pro danou krystalovou mřížku; například: kubický, šestihranný, trojkruhový, kosodélník, mimo jiné.
O těchto pevných látkách se říká, že existují jako krystaly, které zobrazují fazety a geometrické vzory, které odrážejí, jak jsou uvnitř uspořádané. Dalšími příklady krystalických pevných látek jsou diamant, křemen, anthracen, suchý led, chlorid draselný nebo oxid hořečnatý..

Známým párem krystalických pevných látek je cukr a sůl (NaCl). Na první pohled oba ukazují bílé krystaly; ale jejich vlastnosti se enormně liší. Cukr je molekulární krystalická pevná látka, zatímco sůl je iontová krystalická pevná látka. První je tvořen molekulami sacharózy; a druhý, Na iontů+ a Cl-.
Obrázek výše ukazuje, jak jasné mohou být krystaly cukru. Krystaly soli však nezůstávají pozadu. I když se cukr a sůl zdají jako bratři, jejich struktura je odlišná: cukr, kterým je sacharóza, má monoklinickou strukturu; zatímco sůl, kubická struktura.
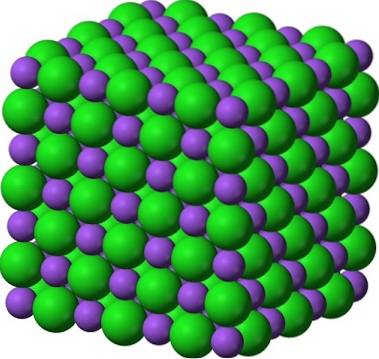
Práškový cukr a sůl (poleva) zůstávají krystalické; jeho krystaly se pro naše oči zmenšily jen o tolik. Krystalinita pevné látky je proto definována spíše její vnitřní strukturou, než vnějším vzhledem nebo jasem..
Rejstřík článků
- 1 Struktura krystalických pevných látek
- 2 Vlastnosti
- 3 typy krystalických pevných látek
- 3.1 iontový
- 3.2 Kovové
- 3,3 Molekulární
- 3.4 Kovalentní sítě
- 4 příklady
- 4.1 Iontový
- 4.2 Kovové
- 4,3 Molekulární
- 4.4 Kovalentní sítě
- 5 Reference
Struktura krystalických pevných látek
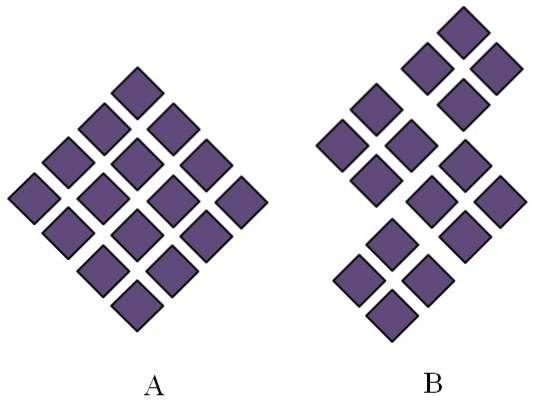
Krystalické pevné látky mají uspořádané struktury. Jejich geometrické charakteristiky budou záviset na typu krystalické mřížky, ke které patří, která se zase promítá zvenčí ve formách krystalu (krystalický systém). Obrázek výše ilustruje dva důležité koncepty těchto struktur: periodicitu a krystalická zrna..
Prostorové uspořádání částic krystalické pevné látky je periodické; to znamená, že se opakuje znovu a znovu ve všech směrech. To vytváří vlastní strukturní vzor pro každou pevnou a krystalovou mřížku; například zde se začíná odlišovat sůl a cukr nad rámec jejich chemické povahy.
V A jsou kosočtverce uspořádány tak, aby vznikl kosočtverec větších rozměrů. Každý fialový kosočtverec představuje částici nebo soubor částic (atomy, ionty nebo molekuly). Lze tedy očekávat, že makroskopický krystal A bude mít kosodélníkový vzhled..
Mezitím jsou v B kosočtverce uspořádány tak, že vytvářejí krystalická zrna; jsou to velmi malé krystaly (krystaly). B se pak říká, že je polykrystalická pevná látka; to znamená, že je tvořen aglomerací více krystalitů.
Závěrem lze konstatovat, že pevná látka může být jednoduše krystalická (A) nebo polykrystalická (B); A tvoří krystaly, zatímco B polykrystaly.
Vlastnosti
Vlastnosti krystalických pevných látek závisí na jejich typu krystalu. Již je známo, že jejich struktury jsou řádné a že také mají tendenci představovat jasné rysy, které si milovníci minerálů zamilují. Bylo však zmíněno, že prášková pevná látka, dokonce „vypnutá“, může být také klasifikována jako krystalická..
Způsob, jakým jsou jejich částice prostorově orientovány, jim umožňuje mít některé důležité vlastnosti pro jejich charakterizaci. Například krystalické pevné látky jsou schopné difrakce rentgenových paprsků, čímž vytvářejí difrakční spektra, ze kterých lze určit mikroskopickou strukturu krystalu..
Také proto, že struktura je periodická, teplo difunduje stejným způsobem po celé pevné látce; pokud tam nejsou žádné nečistoty. Body tání krystalické pevné látky jsou tedy konstantní a nemění se bez ohledu na to, jak jsou měřeny..
Druhy krystalických pevných látek
Typy krystalických pevných látek jsou založeny na tom, z jakého typu částic jsou vyrobeny a jaké jsou jejich interakce nebo vazby. V zásadě existují čtyři typy: iontové, kovové, molekulární a kovalentní sítě.
I když představují určitý stupeň nečistot, zůstávají krystalické, i když jsou ovlivněny jejich vlastnosti a nevykazují stejné hodnoty očekávané pro čistou pevnou látku..
Ionics
Sůl je příkladem iontové krystalické pevné látky, protože je složena z iontů Na+ a Cl-. Proto v tomto typu pevných látek vládne iontová vazba: strukturální uspořádání řídí elektrostatické síly..
Kovový
Všechny kovové atomy tvoří kovové krystaly. To znamená, že například stříbrná vidlice je konglomerát kondenzovaných stříbrných krystalů. Vnitřní nebo mikroskopická struktura je stejná v každém rozpětí ruky objektu a zůstává nezměněna od rukojeti vidlice po špičku zubů..
Molekulární
Cukr je příkladem molekulární krystalické pevné látky, protože je tvořen molekulami sacharózy. Proto je tento typ pevné látky tvořen molekulami, které prostřednictvím svých intermolekulárních interakcí (a nikoli kovalentních vazeb) dokáží vytvořit uspořádanou strukturu..
Kovalentní sítě
Konečně máme krystalické pevné látky kovalentních sítí. Kovalentní vazby v nich převládají, protože jsou odpovědné za stanovení řádu a udržení atomů silně fixovaných v příslušných prostorových pozicích. Nemluvíme o iontech, atomech nebo molekulách, ale o trojrozměrných sítích.
Příklady
Dále a nakonec budou citovány některé příklady pro každý z typů krystalických pevných látek.
Ionics
Všechny soli jsou iontové pevné látky. Podobně existují sulfidy, hydroxidy, oxidy, halogenidy a další sloučeniny, které jsou také tvořeny ionty, nebo jejich interakce jsou v podstatě iontové. Takže máme:
-KCl
-Případ4
-Ba (OH)dva
-KURS4
-FeCl3
-NadvaS
-MgO
-CaFdva
-NaHCO3
-(NH4)dvaCrO4
Kromě těchto příkladů je drtivá většina minerálů považována za iontové krystalické pevné látky.
Kovový
Jakýkoli kovový prvek se přirozeně vyskytuje jako kovové krystaly. Někteří z nich jsou:
-Měď
-Žehlička
-Hliník
-Chrome
-Kovový vodík (za nepředstavitelných tlaků)
-Wolfram
-Zirkonium
-Titan
-Hořčík
-Sodík
Molekulární
Existuje velké množství molekulárních krystalických pevných látek. Prakticky každá organická sloučenina, která tuhne, může vytvářet krystaly, pokud je její čistota vysoká, nebo pokud její struktura není příliš složitá. Takže máme:
-Led (HdvaNEBO)
-Suchý led (COdva)
-Jádva
-P4
-S8 (a jeho polymorfy)
-Anthracen
-Pevný kyslík
-Pevný amoniak
-Fenolftalein
-Kyselina benzoová
Kovalentní sítě
A konečně, mezi některými krystalickými pevnými látkami kovalentních sítí máme:
-diamant
-Grafit
-Uhlíkové nanotrubice
-Fullereny
-Křemen
-Křemík
-Germanium
-Nitrid boru
Z tohoto seznamu lze uhlíkové nanotrubice a fullereny také považovat za molekulární krystalické pevné látky. Je to proto, že i když se skládají z kovalentně vázaných atomů uhlíku, definují jednotky, které lze vizualizovat jako makromolekuly (fotbalové míče a zkumavky)..
Reference
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). Učení CENGAGE.
- Shiver & Atkins. (2008). Anorganická chemie. (Čtvrté vydání). Mc Graw Hill.
- Wikipedia. (2020). Krystal. Obnoveno z: en.wikipedia.org
- Chemistry LibreTexts. (16. června 2019). Krystalické a amorfní pevné látky. Obnoveno z: chem.libretexts.org
- Rachel Bernstein a Anthony Carpi. (2020). Vlastnosti těles. Obnoveno z: visionlearning.com



Zatím žádné komentáře