
Historie molekulární kinetické teorie, postuláty a příklady

The molekulární kinetická teorie Ten se snaží vysvětlit experimentální pozorování plynů z mikroskopické perspektivy. To znamená, že se snaží spojit povahu a chování plynných částic s fyzikálními vlastnostmi plynu jako kapaliny; vysvětlete makroskopické z mikroskopického.
Plyny byly pro vědce vždy zajímavé kvůli jejich vlastnostem. Zabírají celý objem nádoby, ve které se nacházejí, přičemž je možné je zcela stlačit, aniž by jejich obsah byl v rozporu s nejmenším odporem; a pokud se teplota zvýší, nádoba se začne rozpínat a může dokonce prasknout.
Mnoho z těchto vlastností a chování je shrnuto v zákonech ideálního plynu. Považují však plyn za celek, nikoli za soubor milionů částic rozptýlených ve vesmíru; Kromě toho neposkytuje na základě údajů o tlaku, objemu a teplotě další informace o tom, jak se tyto částice pohybují.
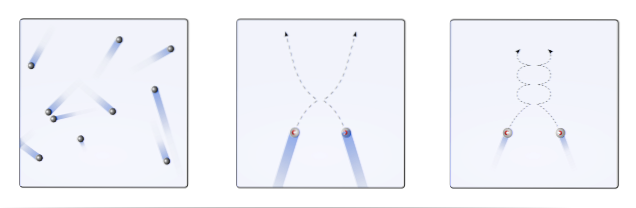
Tehdy tedy molekulární kinetická teorie (TCM) navrhuje vizualizovat je jako mobilní sféry (horní obrázek). Tyto koule se navzájem kolidují a stěnami libovolně a udržují lineární trajektorii. Když se však teplota sníží a tlak se zvýší, trajektorie koulí se zakřiví..
Plyn by se podle TCM měl chovat jako koule v prvním snímku obrazu. Ale ochlazením a zvýšením tlaku na ně jejich chování zdaleka není ideální. Jsou to pak skutečné plyny, které se blíží zkapalňování a přecházejí do kapalné fáze.
Za těchto podmínek se interakce mezi koulemi stávají důležitějšími do té míry, že se jejich rychlosti na okamžik zpomalí. Čím blíže jsou ke zkapalnění, tím více se jejich trajektorie stávají křivkami (vložka vpravo) a jejich kolize jsou méně energické.
Rejstřík článků
- 1 Historie
- 1.1 Daniel Bernoulli
- 1.2 Rudolf Clausius
- 1.3 James Clerk Maxwell a Ludwig Boltzmann
- 2 Postuláty teorie molekulární kinetiky
- 2.1 Objem plynných částic je zanedbatelný
- 2.2 Síly přitažlivosti mezi částicemi jsou nulové
- 2.3 Plynné částice jsou vždy v pohybu
- 2.4 Kolize mezi částicemi a stěnami nádoby jsou elastické
- 2.5 Kinetická energie nezůstává konstantní
- 2.6 Průměrná kinetická energie se rovná dané teplotě pro všechny plyny
- 3 příklady
- 3.1 Boyleův zákon
- 3.2 Charlesův zákon
- 3.3 Daltonův zákon
- 4 Odkazy
Příběh
Daniel Bernoulli
Myšlenku těchto sfér, lépe nazývaných atomy, již zvažoval římský filozof Lucretius; ne pro plyny, ale pro pevné, statické předměty. Na druhou stranu Daniel Bernoulli v roce 1738 aplikoval atomové vidění na plyny a kapaliny tím, že si je představoval jako neuspořádané koule pohybující se všemi směry..
Jeho práce však porušovala tehdejší fyzikální zákony; tělo se nemohlo věčně hýbat, takže nebylo možné si myslet, že se soubor atomů a molekul srazí, aniž by ztratily svoji energii; to znamená, že existence elastických kolizí nebyla možná.
Rudolf clausius
O století později jiní autoři vyztužili TCM modelem, kde se plynné částice pohybovaly pouze jedním směrem. Rudolf Clausius však shromáždil své výsledky a sestavil komplexnější model TCM, pomocí kterého se snažil vysvětlit zákony ideálního plynu, které prokázali Boyle, Charles, Dalton a Avogadro..
James Clerk Maxwell a Ludwig Boltzmann
V roce 1859 James Clerk Maxwell uvedl, že plynné částice vykazují při dané teplotě řadu rychlostí a že o jejich množině lze uvažovat pomocí průměrné molekulární rychlosti..
Poté v roce 1871 spojil Ludwig Boltzmann existující myšlenky s entropií a to, jak má plyn termodynamicky vždy tendenci zabírat co nejvíce prostoru homogenně a spontánně.
Postuláty teorie molekulární kinetiky
Pro zvážení plynu z jeho částic je nezbytný model, ve kterém jsou splněny určité postuláty nebo předpoklady; postuluje, že logicky musí být schopen předvídat a co nejpřesněji vysvětlovat makroskopická a experimentální pozorování. To znamená, že jsou zmíněny a popsány postuláty TCM.
Objem plynných částic je zanedbatelný
V nádobě naplněné plynnými částicemi se tyto rozptýlí a vzdalují se od sebe ve všech rozích. Pokud by je na okamžik mohli všichni spojit v určitém bodě nádoby, aniž by došlo ke zkapalnění, bylo by pozorováno, že zabírají pouze zanedbatelnou část objemu nádoby..
To znamená, že nádoba, i když obsahuje miliony plynných částic, je ve skutečnosti prázdnější než plná (poměr objemových dutin mnohem menší než 1); proto, pokud to její bariéry dovolí, může dojít k náhlému stlačení jemu i plynu uvnitř; protože na konci dne jsou částice velmi malé, stejně jako jejich objem.
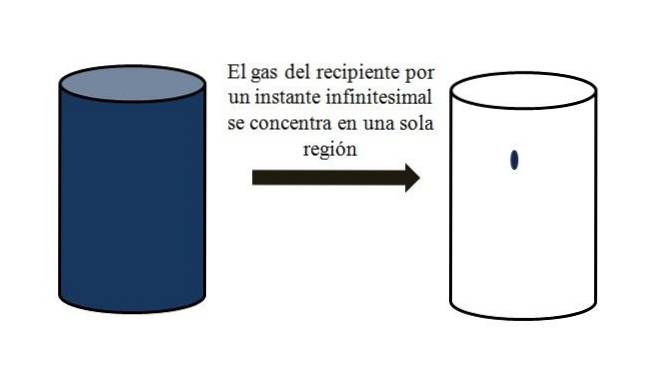
Horní obrázek přesně ilustruje výše uvedené pomocí modravě zbarveného plynu.
Atraktivní síly mezi částicemi jsou nulové
Plynné částice uvnitř nádoby se srazí navzájem bez dostatečného času na to, aby jejich interakce získaly sílu; ještě méně, když to, co je hlavně obklopuje, je molekulární vakuum. Okamžitým důsledkem toho je, že jejich lineární cesty jim umožňují úplně obsáhnout objem kontejneru..
Pokud by tomu tak nebylo, nádoba s „bizarním“ a „labyrintovým“ tvarem by měla vlhké oblasti v důsledku kondenzace plynu; místo toho částice cestují kolem kontejneru s plnou svobodou, aniž by je zastavila síla jejich interakcí.
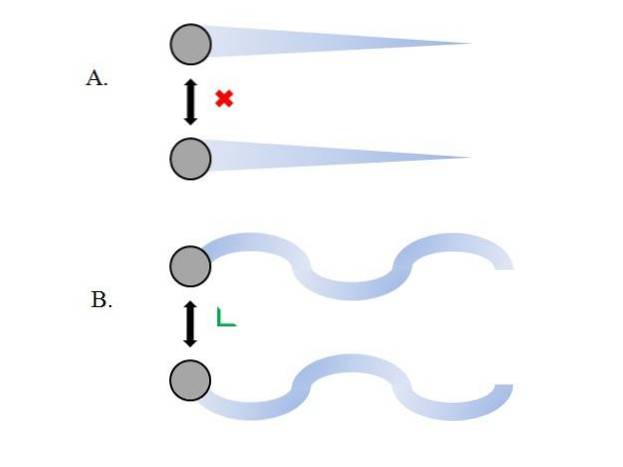
Lineární trajektorie horního obrazu (A.) ukazují tento postulát; zatímco jsou-li trajektorie zakřivené (B.), ukazuje to, že existují interakce, které nelze mezi částicemi ignorovat.
Plynné částice jsou vždy v pohybu
Z prvních dvou postulátů také konverguje skutečnost, že plynné částice se nikdy nepřestávají pohybovat. Jakmile jsou v kontejneru rozmazané, srazí se navzájem a se stěnami, silou a rychlostí přímo úměrnou absolutní teplotě; tato síla je tlak.
Pokud by se plynné částice na okamžik přestaly pohybovat, byly by uvnitř nádoby pozorovány „kouřové jazyky“, vynořující se odnikud, s dostatečným časem, aby se uspořádaly ve vakuu a poskytly náhodné tvary..
Kolize mezi částicemi a stěnami nádoby jsou elastické
Pokud uvnitř nádoby převládají pouze elastické srážky mezi plynnými částicemi a stěnami nádoby, ke kondenzaci plynu nikdy nedojde (pokud se nezmění fyzikální podmínky); nebo co je stejné jako říkat, že nikdy neodpočívají a vždy se srazí.
Je to proto, že při elastických srážkách nedochází k čisté ztrátě kinetické energie; částice se srazí se stěnou a odráží se stejnou rychlostí. Pokud částice při srážce zpomalí, druhá akceleruje, aniž by produkovala teplo nebo zvuk, který rozptyluje kinetickou energii kteréhokoli z nich.
Kinetická energie nezůstává konstantní
Pohyb částic je náhodný a chaotický, takže ne všechny mají stejnou rychlost; stejně jako se to děje například na dálnici nebo v davu. Některé jsou energičtější a cestují rychleji, zatímco jiné jsou pomalé a čekají na kolizi, aby je urychlily.
Abychom popsali jeho rychlost, je nutné vypočítat průměr; a tím se získá průměrná kinetická energie plynných částic nebo molekul. Jelikož se kinetická energie všech částic neustále mění, průměr umožňuje lepší kontrolu nad daty a lze na něj pracovat s větší spolehlivostí..
Průměrná kinetická energie se rovná dané teplotě pro všechny plyny
Průměrná molekulární kinetická energie (ECmp) v nádobě se mění s teplotou. Čím vyšší je teplota, tím vyšší bude energie. Protože se jedná o průměr, mohou existovat částice nebo plyny, které mají vyšší nebo nižší energii než tato hodnota; některé rychlejší a jiné pomaleji.
Matematicky lze prokázat, že ECmp záleží výhradně na teplotě. To znamená, že bez ohledu na to, jaký plyn je, jeho hmotnost nebo molekulární struktura, jeho ECmp bude stejný při teplotě T a bude se měnit, pouze pokud se zvýší nebo sníží. Ze všech postulátů je to možná nejdůležitější..
A co průměrná molekulární rychlost? Na rozdíl od ECmp, molekulová hmotnost ovlivňuje rychlost. Čím těžší jsou plynné částice nebo molekuly, je přirozené očekávat, že se budou pohybovat pomaleji..
Příklady
Zde je několik krátkých příkladů toho, jak se TCM podařilo vysvětlit zákony o ideálním plynu. I když to není popsáno, lze pomocí TCM vysvětlit i další jevy, jako je difúze a výpotek plynu.
Boyleův zákon
Pokud je objem nádoby stlačen při konstantní teplotě, zmenší se vzdálenost, kterou musí plynné částice cestovat, aby se srazily se stěnami; což se rovná zvýšení frekvence takových kolizí, což má za následek větší tlak. Protože teplota zůstává konstantní, ECmp je také konstantní.
Charles Law
Pokud zvýšíte T, ECmp se zvýší. Plynné částice se budou pohybovat rychleji a vícekrát se srazí se stěnami nádoby; takže se zvyšuje tlak.
Pokud jsou stěny pružné a schopné se rozpínat, jejich plocha se zvětší a tlak bude klesat, dokud se nestane konstantní; a v důsledku toho se také zvýší hlasitost.
Daltonův zákon
Pokud by se do prostorné nádoby, pocházející z menších nádob, přidalo několik litrů různých plynů, její celkový vnitřní tlak by se rovnal součtu parciálních tlaků vyvíjených každým typem plynu samostatně..
Proč? Protože všechny plyny začínají kolidovat a homogenně se rozptylovat; interakce mezi nimi jsou nulové a vakuum převládá v nádobě (TCM postuláty), takže je to, jako by každý plyn byl sám a vyvíjel svůj tlak jednotlivě bez rušení ostatních plynů.
Reference
- Whitten, Davis, Peck a Stanley. (2008). Chemie. (8. vydání). CENGAGE Learning, P 426-431.
- Fernandez Pablo. (2019). Molekulární kinetická teorie. Vix. Obnoveno z: vix.com
- Jones, Andrew Zimmerman. (7. února 2019). Kinetická molekulární teorie plynů. Obnoveno z: thoughtco.com
- Hall Nancy. (5. května 2015). Kinetická teorie plynů. Glenn Research Center. Obnoveno z: grc.nasa.gov
- Blaber M. & Lower S. (9. října 2018). Základy kinetické molekulární teorie. Chemistry LibreTexts. Obnoveno z: chem.libretexts.org
- Kinetická molekulární teorie. Obnoveno z: chemed.chem.purdue.edu
- Wikipedia. (2019). Kinetická teorie plynů. Obnoveno z: en.wikipedia.org
- Toppr. (s.f.). Kinetická molekulární teorie plynů. Obnoveno z: toppr.com



Zatím žádné komentáře