
Druhy chemických vazeb

Chemické vazby jsou síly, které drží atomy pohromadě za vzniku molekul. Mezi atomy existují tři typy vazeb:
- Kovová vazba.
- Iontová vazba.
- Kovalentní vazba: nepolární, polární, jednoduchá, dvojitá, trojitá, dativní.
Díky těmto vazbám vznikají všechny sloučeniny, které existují v přírodě. Existují také síly, které drží molekuly pohromadě, známé jako mezimolekulární vazby, například:
- Vodíkové vazby nebo vazby.
- Dipól-dipólové síly.
Dále vysvětlíme každý z těchto odkazů.
| Druhy chemické vazby | Charakteristický | Příklady | |
|---|---|---|---|
| Kov | Kovové ionty se vznášejí v moři pohybujících se elektronů. | Kovové prvky: sodík, baryum, stříbro, železo, měď. | |
| Iontový | Přenos elektronů z jednoho atomu na druhý. | Chlorid sodný Na+Cl- | |
| Kovalentní | Nepolární | Sdílejte elektrony rovnoměrně mezi dvěma atomy. | Molekulární vodík H-H nebo Hdva |
| Polární | Sdílejte elektrony nerovnoměrně mezi dvěma atomy. | Molekula vody HdvaNEBO | |
| Jednoduchý | Sdílejte pár elektronů. | Molekula chloru Cldva Cl-Cl | |
| Dvojnásobek | Sdílejte dva páry elektronů. | Molekula kyslíku Odva O = O | |
| Trojnásobný | Sdílejte tři páry elektronů. | Molekula dusíku N≣N nebo Ndva | |
| Dativ | Pouze jeden z atomů sdílí elektrony. | Vazba mezi dusíkem a borem ve sloučenině amonium-boritý trifluorid. | |
| Mezimolekulární síly | Vodíkový můstek | Vodíky jedné molekuly jsou přitahovány k elektronegativním atomům jiné molekuly. | Vodíkové vazby mezi vodíkem jedné molekuly vody s kyslíkem jiné molekuly vody. |
| Dipól-dipól | Molekuly se dvěma elektrickými póly přitahují opačné póly jiných molekul. | Interakce mezi methanal H molekulamidvaC = O | |
Kovová vazba
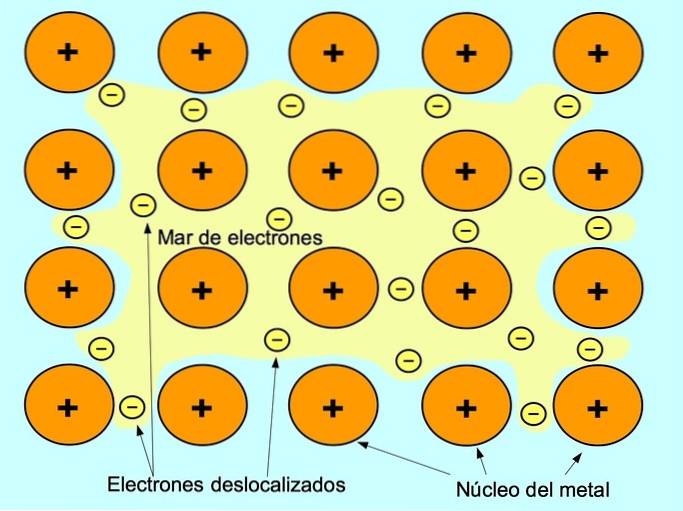
Kovová vazba je síla přitažlivosti mezi kladnými ionty kovových prvků a zápornými elektrony, které se mezi ionty volně pohybují. Atomy kovů jsou pevně zabalené, což umožňuje elektronům pohyb v mřížce atomů.
V kovech se valenční elektrony uvolňují z původního atomu a vytvářejí „moře“ elektronů, které se vznáší kolem celé kovové struktury. To způsobí, že se atomy kovů transformují na kladně nabité ionty kovů, které se sbalí..
Kovová vazba je vytvořena mezi kovovými prvky, jako je sodík Na, baryum Ba, vápník Ca, hořčík Mg, zlato Au, stříbro Ag a hliník Al.
Iontová vazba
Iontová vazba je síla, která spojuje kovový prvek, jako je sodík nebo hořčík, s nekovovým prvkem, jako je chlor nebo síra. Kov ztrácí elektrony a transformuje se na pozitivní iont kovu kation. Tyto elektrony procházejí do nekovového prvku a ten se transformuje na záporně nabitý iont anion.
Kationty a anionty kombinují a tvoří trojrozměrnou síť, která je udržována silami elektrostatické přitažlivosti mezi ionty s různými náboji. Tyto síly tvoří iontové sloučeniny.
Zemská kůra je složena převážně z iontových sloučenin. Většina hornin, minerálů a drahých kamenů jsou iontové sloučeniny. Například:
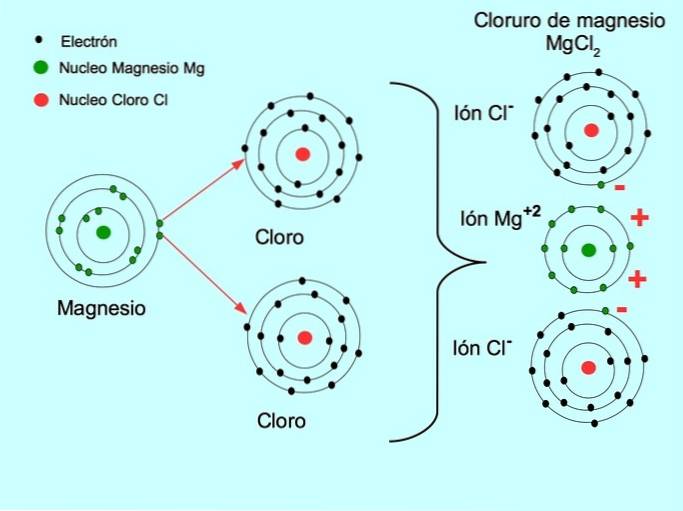
- Chlorid sodný NaCl: kovovým prvkem je sodík, který přenáší elektron na chlor, což je nekovový prvek.
- Chlorid hořečnatý MgCldva: Hořčík Mg daruje dva elektrony dvěma atomům chloru, jak je znázorněno na obrázku níže:
Viz také Rozdíl mezi kationty a anionty.
Kovalentní vazba
Kovalentní vazba se vytvoří, když dva nekovové atomy sdílejí elektrony. Tato vazba může být několika typů v závislosti na afinitě atomů k elektronům a množství sdílených elektronů.
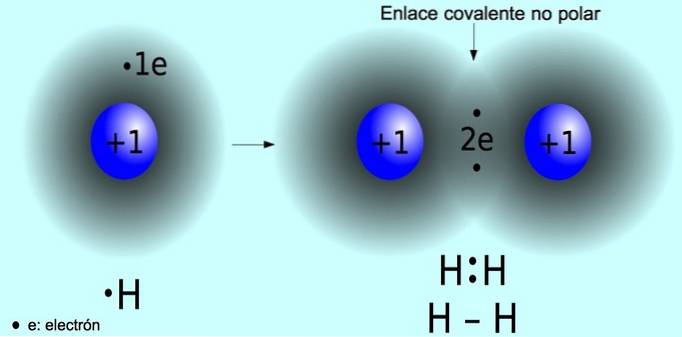
Nepolární kovalentní vazba
Nepolární kovalentní vazba je vazba, která se tvoří mezi dvěma atomy, kde jsou elektrony sdíleny rovnoměrně. Tato vazba se normálně vyskytuje v symetrických molekulách, tj. V molekulách složených ze dvou stejných atomů, jako je molekula vodíku Hdva a molekula kyslíku Odva.
Polární kovalentní vazba
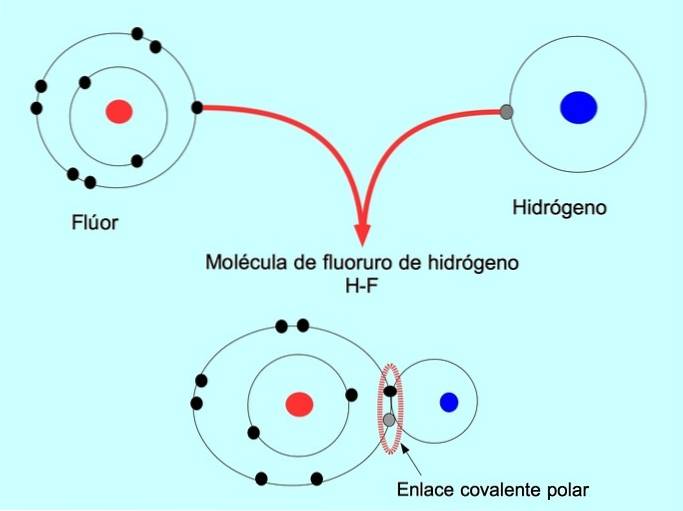
Polární kovalentní vazba se vytvoří, když dva atomy sdílejí elektrony, ale jeden z nich má větší přitažlivost pro elektrony. Díky tomu má molekula zápornější „pól“ s větším počtem elektronů a opačný pól je pozitivnější..
Molekuly s touto distribucí nebo nerovnováhou elektronů jsou známé jako polární. Například v HF fluorovodíku existuje kovalentní vazba mezi vodíkem a fluorem, ale fluor má vyšší elektronegativitu, takže silněji přitahuje sdílené elektrony..
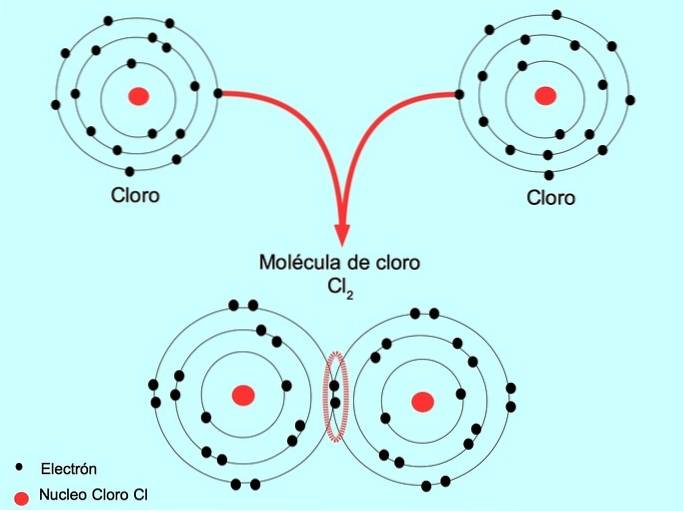
Jednoduchá kovalentní vazba
Když dva atomy sdílejí dva elektrony, jeden od každého, vzniklá kovalentní vazba se nazývá jednoduchá kovalentní vazba.
Například chlor je atom, který má ve vnějším obalu sedm valenčních elektronů, které lze naplnit osmi elektrony. Chlór se může kombinovat s jiným chlorem za vzniku molekuly chloru Cldva což je mnohem stabilnější než samotné chlory.
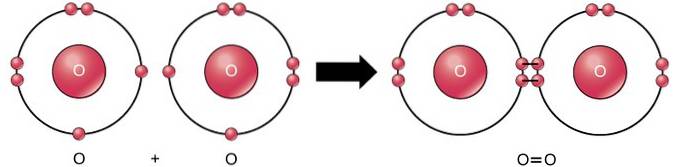
Dvojitá kovalentní vazba
Dvojitá kovalentní vazba je vazba, kde jsou čtyři elektrony (dva páry) elektronů sdíleny mezi dvěma atomy. Například kyslík má ve své poslední skořápce 6 elektronů. Když se spojí dva kyslíky, sdílejí se mezi nimi čtyři elektrony, přičemž každý z nich má v poslední skořápce 8 elektronů..
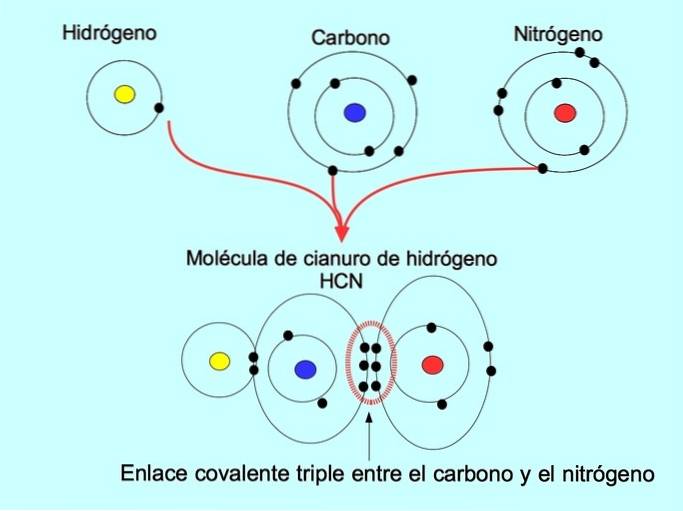
Trojitá kovalentní vazba
Trojitá kovalentní vazba se vytvoří, když je mezi dvěma atomy sdíleno 6 elektronů (nebo tři páry). Například v molekule kyanovodíku HCN se vytvoří trojná vazba mezi uhlíkem a dusíkem, jak je znázorněno na obrázku níže:
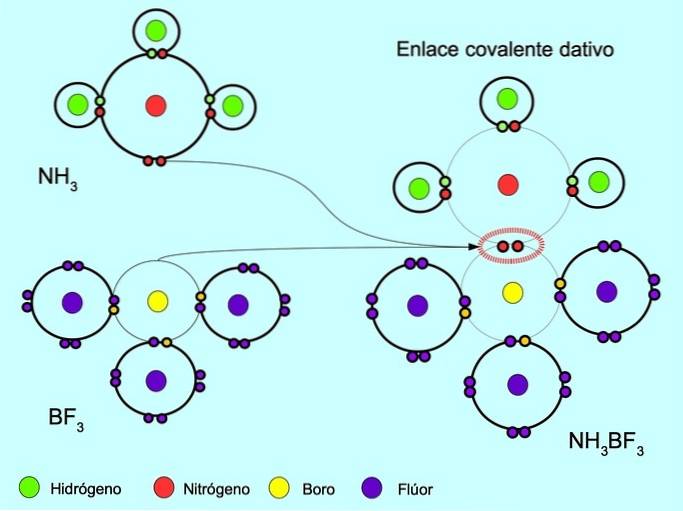
Souřadnicová nebo dativní kovalentní vazba
Koordinovaná nebo dativní kovalentní vazba je vazba, která se tvoří, když pouze jeden z atomů ve vazbě přispívá dvojicí elektronů. Například když amoniak NH reaguje3 s fluoridem boritým BF3, Dusíkaté vazby se dvěma elektrony přímo na bór, který nemá k dispozici žádné elektrony ke sdílení. Tímto způsobem je dusíku i boru ponecháno 8 elektronů ve valenčním plášti..
Viz také Organické a anorganické sloučeniny.
Mezimolekulární vazby
Molekuly se sdružují prostřednictvím sil, které umožňují vytvářet látky v kapalném nebo pevném stavu.
Dipól-dipólové vazby nebo síly
Slabé mezimolekulární vazby mohou být vytvořeny mezi polárními molekulami, když jsou negativní póly přitahovány k pozitivním pólům a naopak. Například methanal HdvaC = O je polární molekula s částečným záporným nábojem na kyslíku a částečným kladným nábojem na vodících. Pozitivní stránka jedné molekuly methanalu přitahuje negativní stranu jiné molekuly methanalu.
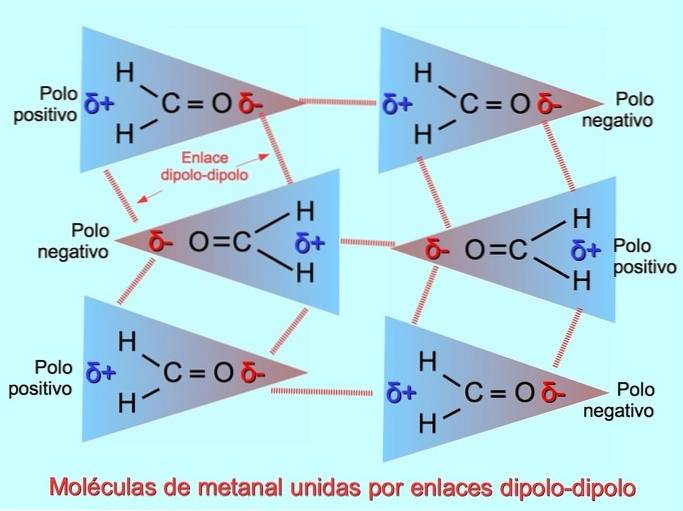
Vodíkové vazby nebo vazby
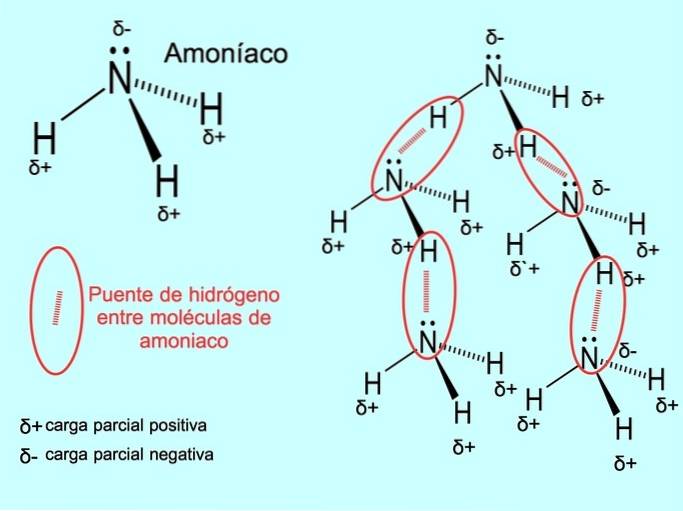
Vodíková vazba nebo vodíková vazba je vazba, která je vytvořena mezi molekulami. K tomu dochází, když je vodík v molekule kovalentně vázán na kyslík, dusík nebo fluor. Kyslík, dusík a fluor jsou atomy s vyšší elektronegativitou, proto přitahují elektrony silněji, když je sdílejí s jiným méně elektronegativním atomem..
Mezi molekulami vody H jsou vodíkové vazbydvaO a NH amoniak3 jak ukazuje obrázek:
Mohlo by vás zajímat:
- Atomy a molekuly.
- Příklady organických a anorganických sloučenin.
Reference
Zumdahl, S.S., Zumdahl, S.A. (2014) Chemistry. Deváté vydání. Brooks / Cole. Belmont.
Commons, C., Commons, P. (2016) Heinemann Chemistry 1. 5. vydání. Pearson Austrálie. Melbourne.



Zatím žádné komentáře