
Struktura kyseliny bromovodíkové (HBr), vlastnosti, tvorba

The kyselina bromovodíková Jedná se o anorganickou sloučeninu, která je výsledkem vodného rozpouštění plynu zvaného bromovodík. Jeho chemický vzorec je HBr a lze jej zvažovat různými ekvivalentními způsoby: jako molekulární hydrid nebo halogenovodík ve vodě; tj. hydracid.
V chemických rovnicích by to mělo být psáno jako HBr (ac), což znamená, že jde o kyselinu bromovodíkovou a ne o plyn. Tato kyselina je jednou z nejsilnějších známých, ještě více než kyselina chlorovodíková, HCl. Vysvětlení spočívá v povaze jeho kovalentní vazby.
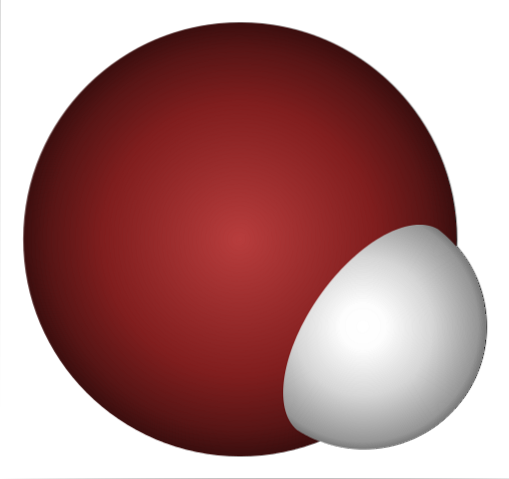
Proč je HBr tak silná kyselina a ještě více rozpuštěná ve vodě? Protože kovalentní vazba H-Br je velmi slabá, kvůli špatnému překrytí 1s orbitalů H a 4p Br.
To není překvapující, pokud se podíváte pozorně na obrázek výše, kde je jasně atom bromu (hnědý) mnohem větší než atom vodíku (bílý).
Následkem toho jakékoli narušení způsobí přerušení vazby H-Br a uvolnění iontu H.+. Kyselina bromovodíková je tedy Brönstedovou kyselinou, protože přenáší protony nebo vodíkové ionty. Jeho síla je taková, že se používá při syntéze různých organobromovaných sloučenin (jako je 1-bromethan, CH3CHdvaBr).
Kyselina bromovodíková je po jodovodíkové HI jednou z nejsilnějších a nejužitečnějších hydrracidů pro trávení určitých pevných vzorků.
Rejstřík článků
- 1 Struktura kyseliny bromovodíkové
- 1.1 Kyselost
- 2 Fyzikální a chemické vlastnosti
- 2.1 Molekulární vzorec
- 2.2 Molekulová hmotnost
- 2.3 Fyzický vzhled
- 2.4 Zápach
- 2.5 Prahová hodnota zápachu
- 2.6 Hustota
- 2.7 Teplota tání
- 2.8 Bod varu
- 2.9 Rozpustnost ve vodě
- 2.10 Hustota par
- 2.11 Kyselost pKa
- 2.12 Kalorická kapacita
- 2.13 Standardní molární entalpie
- 2.14 Standardní molární entropie
- 2.15 Bod vzplanutí
- 3 Názvosloví
- 4 Jak se tvoří?
- 4.1 Směs vodíku a bromu ve vodě
- 4.2 Tribromid fosforitý
- 4.3 Oxid siřičitý a brom
- 5 použití
- 5.1 Příprava bromidů
- 5.2 Syntéza alkylhalogenidů
- 5.3 Katalyzátor
- 6 Reference
Struktura kyseliny bromovodíkové
Obrázek ukazuje strukturu H-Br, jejíž vlastnosti a vlastnosti, i když jsou to vlastnosti plynu, úzce souvisí s jeho vodnými roztoky. Proto dochází k bodu, kdy dochází ke zmatku ohledně toho, na kterou ze dvou sloučenin se odkazuje: HBr nebo HBr (ac).
Struktura HBr (ac) se liší od struktury HBr, protože molekuly vody nyní tuto diatomickou molekulu řeší. Když je dostatečně blízko, přenáší se H+ na molekulu HdvaNebo jak je uvedeno v následující chemické rovnici:
HBr + HdvaO => Br-- + H3NEBO+
Struktura kyseliny bromovodíkové se tedy skládá z iontů Br-- a H3NEBO+ elektrostaticky interagující. Nyní je to trochu jiné než kovalentní vazba H-Br.
Jeho vysoká kyselost je dána objemným Br aniontem- sotva mohou komunikovat s H3NEBO+, nelze vám zabránit v přenosu H+ jiným okolním chemickým druhům.
Kyselost
Například Cl- a F- i když netvoří kovalentní vazby s H3NEBO+, mohou interagovat prostřednictvím jiných mezimolekulárních sil, jako jsou vodíkové vazby (které pouze F- je schopen je přijmout). Vodíkové vazby F--H-OHdva+ „Překážejte“ darování H.+.
Z tohoto důvodu je kyselina fluorovodíková, HF, slabší kyselinou. ve vodě než kyselina bromovodíková; protože iontové interakce Br- H3NEBO+ neobtěžujte převod H+.
Přestože je voda přítomna v HBr (aq), její chování je nakonec podobné chování molekuly H-Br; to je H+ se převádí z HBr nebo Br-H3NEBO+.
Fyzikální a chemické vlastnosti
Molekulární vzorec
HBr.
Molekulární váha
80,972 g / mol. Všimněte si, že, jak bylo uvedeno v předchozí části, uvažuje se pouze o HBr a ne o molekule vody. Pokud byla molekulová hmotnost převzata ze vzorce Br-H3NEBO+ by měl hodnotu přibližně 99 g / mol.
Fyzický vzhled
Bezbarvá nebo světle žlutá kapalina, která bude záviset na koncentraci rozpuštěného HBr. Čím je žlutější, tím koncentrovanější a nebezpečnější bude.
Zápach
Štiplavý, dráždivý.
Prahová hodnota zápachu
6,67 mg / m3.
Hustota
1,49 g / cm3 (48% hmotn./hmotn. Vodný roztok). Tato hodnota, stejně jako hodnoty odpovídající bodům tání a varu, závisí na množství HBr rozpuštěného ve vodě..
Bod tání
-11 ° C (12 ° F, 393 ° K) (49% w / w vodný roztok).
Bod varu
122 ° C (252 ° F. 393 ° K) při 700 mmHg (vodný roztok 47-49% hmotn./hmotn.).
Rozpustnost ve vodě
-221 g / 100 ml (při 0 ° C).
-204 g / 100 ml (15 ° C).
-130 g / 100 ml (100 ° C).
Tyto hodnoty se vztahují na plynný HBr, ne na kyselinu bromovodíkovou. Jak je vidět, s rostoucí teplotou klesá rozpustnost HBr; chování, které je přirozené v plynech. Pokud jsou tedy požadovány koncentrované roztoky HBr (aq), je lepší pracovat s nimi při nízkých teplotách..
Pokud pracuje při vysokých teplotách, bude HBr unikat ve formě plynných diatomických molekul, takže reaktor musí být uzavřen, aby se zabránilo jeho úniku.
Hustota par
2,71 (vzhledem ke vzduchu = 1).
Kyselost pKa
-9.0. Tato záporná konstanta naznačuje jeho velkou kyselost..
Kalorická kapacita
29,1 kJ / mol.
Standardní molární entalpie
198,7 kJ / mol (298 ° K).
Standardní molární entropie
-36,3 kJ / mol.
bod vznícení
Nehořlavý.
Nomenklatura
Její název „kyselina bromovodíková“ kombinuje dvě skutečnosti: přítomnost vody a to, že brom má ve sloučenině valenci -1. V angličtině je to o něco jasnější: kyselina bromovodíková, kde předpona „hydro“ (nebo hydro) označuje vodu; i když ve skutečnosti může také odkazovat na vodík.
Brom má valenci -1, protože je vázán na atom vodíku méně elektronegativní než on; ale pokud by byl vázán nebo interagoval s atomy kyslíku, může mít četné valence, například: +2, +3, +5 a +7. S H může přijmout pouze jednu valenci, a proto je k jeho názvu přidána přípona -ico.
Zatímco HBr (g), bromovodík, je bezvodý; to znamená, že nemá vodu. Proto je pojmenována podle jiných norem nomenklatury, odpovídajících halogenovodíkům..
Jak se to formuje?
Existuje několik syntetických metod pro přípravu kyseliny bromovodíkové. Někteří z nich jsou:
Směs vodíku a bromu ve vodě
Bez popisu technických podrobností lze tuto kyselinu získat přímým mícháním vodíku a bromu v reaktoru naplněném vodou..
Hdva + Brdva => HBr
Tímto způsobem, jak vzniká HBr, rozpouští se ve vodě; to to může přetáhnout do destilací, takže lze extrahovat roztoky s různými koncentracemi. Vodík je plyn a brom je tmavě načervenalá kapalina.
Tribromid fosforitý
Ve složitějším procesu se mísí písek, hydratovaný červený fosfor a brom. Lapače vody se umístí do ledových lázní, aby se zabránilo úniku HBr a místo toho se vytvořila kyselina bromovodíková. Reakce jsou:
2P + 3Brdva => 2PBr3
PBr3 + 3HdvaO => 3HBr + H3PO3
Oxid siřičitý a brom
Dalším způsobem, jak jej připravit, je reakce bromu s oxidem siřičitým ve vodě:
Brdva + SWdva + 2HdvaO => 2HBr + HdvaSW4
Toto je redoxní reakce. BRdva redukuje, získává elektrony vazbou s vodíky; zatímco SOdva oxiduje, ztrácí elektrony, když vytváří více kovalentní vazby s jinými kyslíky, jako v kyselině sírové.
Aplikace
Příprava bromidu
Soli bromidu lze připravit reakcí HBr (vodného) s hydroxidem kovu. Za produkci bromidu vápenatého se například považuje:
Ca (OH)dva + 2HBr => CaBrdva + HdvaNEBO
Dalším příkladem je bromid sodný:
NaOH + HBr => NaBr + HdvaNEBO
Lze tedy připravit mnoho anorganických bromidů.
Syntéza alkylhalogenidů
A co organické bromidy? Jedná se o organobromované sloučeniny: RBr nebo ArBr.
Dehydratace alkoholu
Surovinou pro jejich získání mohou být alkoholy. Když jsou protonovány kyselostí HBr, tvoří vodu, což je dobře odstupující skupina, a na jejím místě je začleněn objemný atom Br, který se kovalentně váže na uhlík:
ROH + HBr => RBr + HdvaNEBO
Tato dehydratace se provádí při teplotách nad 100 ° C s cílem usnadnit rozbití vazby R-OH.dva+.
Přídavek k alkenům a alkynům
Molekula HBr může být přidána z jejího vodného roztoku na dvojnou nebo trojnou vazbu alkenu nebo alkinu:
RdvaC = CRdva + HBr => RHC-CRBr
RC≡CR + HBr => RHC = CRBr
Lze získat několik produktů, ale za jednoduchých podmínek se produkt primárně tvoří tam, kde je brom vázán na sekundární, terciární nebo kvartérní uhlík (Markovnikovovo pravidlo).
Tyto halogenidy se účastní syntézy dalších organických sloučenin a jejich rozsah použití je velmi rozsáhlý. Podobně mohou být některé z nich dokonce použity při syntéze nebo designu nových léků..
Štěpení etherem
Z etherů lze současně získat dva alkylhalogenidy, každý nesoucí jeden ze dvou postranních řetězců R nebo R 'počátečního etheru R-O-R'. Stává se něco podobného dehydrataci alkoholů, ale jejich mechanismus reakce je odlišný.
Reakci lze popsat následující chemickou rovnicí:
ROR '+ 2HBr => RBr + R'Br
A také se uvolňuje voda.
Katalyzátor
Jeho kyselost je taková, že jej lze použít jako účinný kyselý katalyzátor. Místo přidání aniontu Br- k molekulární struktuře, uvolňuje cestu jiné molekule, aby to dokázala.
Reference
- Graham Solomons T.W., Craig B.Fryhle. (2011). Organická chemie. Miny. (10th edice.). Wiley plus.
- Carey F. (2008). Organická chemie. (Šesté vydání). Mc Graw Hill.
- Steven A. Hardinger. (2017). Ilustrovaný glosář organické chemie: Kyselina bromovodíková. Obnoveno z: chem.ucla.edu
- Wikipedia. (2018). Kyselina bromovodíková. Obnoveno z: en.wikipedia.org
- PubChem. (2018). Kyselina bromovodíková. Obnoveno z: pubchem.ncbi.nlm.nih.gov
- Národní institut bezpečnosti a hygieny při práci. (2011). Bromovodík. [PDF]. Obnoveno z: insht.es
- PrepChem. (2016). Příprava kyseliny bromovodíkové. Obnoveno z: prepchem.com


Zatím žádné komentáře