
Vzorec oxidu siřičitého, vlastnosti, rizika a použití

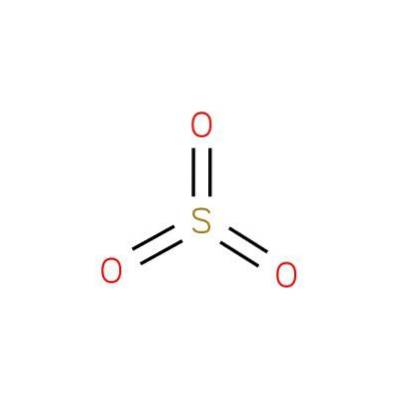
The oxid siřičitý (VI), také známý jako oxid sírový nebo anhydrid kyseliny sírové, je chemická sloučenina vzorce SO3. Jeho struktura je uvedena na obrázku 1 (EMBL-EBI, 2016).
Oxid siřičitý se vyrábí ve zředěné plynné formě v kontaktním procesu s kyselinou sírovou oxidací plynů obsahujících oxid siřičitý..
Doposud však jediným přípravkem čistého oxidu sírového z plynů obsahujících SO3 zředěný, byl pilotním procesem v měřítku zahrnujícím kryoskopickou kondenzaci.
Obvyklý postup místo toho zahrnuje destilaci oleum. Teplo potřebné pro destilaci oleje se nejpohodlněji dodává horkým kontaktním plynem z přidruženého závodu na výrobu kyseliny sírové..
Lze jej připravit v laboratoři zahřátím dýmavé kyseliny sírové a sběrem sublimátu do chlazeného přijímače. Pokud pára kondenzuje nad 27 ° C, získá se gama forma jako kapalina.
Pokud pára kondenzuje pod 27 ° C a za přítomnosti stopy vlhkosti, získá se směs těchto tří forem. Tyto 3 formy lze oddělit frakční destilací.
Fyzikální a chemické vlastnosti oxidu siřičitého
Oxid siřičitý má tvar bílých jehel, které se ve vzduchu mění na kouř. Často se setkáváme s inhibitory, které zabraňují polymeraci (National Center for Biotechnology Information, 2017).
Jeho molekulová hmotnost je 80,066 g / mol, jeho hustota je 1,92 g / cm³ g / ml a jeho teploty tání a varu jsou 16,8 ° C, respektive 44,7 ° C. (Royal Society of Chemistry, 2015).
Sloučenina je kombinována s vodou výbušnou silou, přičemž díky její kyselosti tvoří kyselinu sírovou. Oxid sírový karbonizuje organické látky.
Oxid siřičitý rychle absorbuje vlhkost a vydává husté bílé výpary. Roztoky oxidu v kyselině sírové se nazývají dýmavá kyselina sírová nebo oleum. (Oxid sírový, 2016).
Reakce oxidu sírového a difluoridu kyslíku je velmi prudká a při reakci bez přítomnosti rozpouštědla dochází k výbuchům. Reakce přebytečného oxidu sírového s tetrafluorethylenem způsobuje explozivní rozklad karbonylfluoridu a oxidu siřičitého..
Reakce bezvodé kyseliny chloristé s oxidem sírovým je prudká a je doprovázena vývojem značného tepla. Kapalný oxid sírový prudce reaguje s nitrilchloridem, a to i při 75 ° C.
Reakce oxidu sírového a oxidu olovnatého způsobuje bílou luminiscenci. Kombinace jodu, pyridinu, oxidu sírového a formamidu vyvinula po několika měsících plyn nadměrným tlakem.
Je to způsobeno pomalou tvorbou kyseliny sírové, vnější vodou nebo dehydratací formamidu na kyanovodík (SIRFUR TRIOXIDE, S.F.).
Reaktivita a nebezpečí
Oxid sírový je stabilní sloučenina, nekompatibilní s organickými materiály, jemně práškovanými kovy, zásadami, vodou, kyanidy a řadou dalších chemikálií..
Látka je silným oxidantem a prudce reaguje s hořlavými a redukčními materiály a organickými sloučeninami a způsobuje nebezpečí požáru a výbuchu.
Prudce reaguje s vodou a vlhkým vzduchem za vzniku kyseliny sírové. Roztok ve vodě je silná kyselina, prudce reaguje s bázemi a jsou to korozivní kovy tvořící hořlavý / výbušný plyn.
Sloučenina je korozivní pro kovy a tkaniny. Způsobuje poleptání očí a kůže. Požití způsobuje těžké popáleniny v ústech, jícnu a žaludku. Výpary jsou velmi toxické při vdechování. (Národní institut pro bezpečnost a ochranu zdraví při práci, 2015)
V případě kontaktu s očima zkontrolujte, zda nosíte kontaktní čočky, a ihned je vyjměte. Oči by měly být proplachovány tekoucí vodou po dobu nejméně 15 minut, přičemž víčka udržujte otevřená. Lze použít studenou vodu. Oční mast by se neměla používat.
Pokud chemikálie přijde do styku s oděvem, co nejdříve ji odstraňte, abyste si chránili ruce a tělo. Umístěte postiženého pod bezpečnostní sprchu.
Pokud se chemikálie hromadí na exponované pokožce oběti, například na rukou, kontaminovaná kůže se jemně a opatrně omyje tekoucí vodou a neabrazivním mýdlem. Lze použít studenou vodu. Pokud podráždění přetrvává, vyhledejte lékařskou pomoc. Kontaminovaný oděv před dalším použitím vyperte.
V případě vdechnutí by měl být postižený ponechán v klidu na dobře větraném místě. Pokud je vdechnutí těžké, měla by být oběť co nejdříve evakuována do bezpečného prostoru. Uvolněte těsné oblečení, jako je límeček, opasek nebo kravata.
Pokud postižený dýchá obtížně, měl by být podán kyslík. Pokud postižený nedýchá, provede se resuscitace z úst do úst. Vždy mějte na paměti, že pro osobu poskytující pomoc může být resuscitace z úst do úst nebezpečná, pokud je vdechovaný materiál toxický, infekční nebo žíravý..
Ve všech případech je třeba vyhledat okamžitou lékařskou pomoc (Bezpečnostní list materiálu Oxid siřičitý, 2013).
Aplikace
Oxid siřičitý je základním činidlem při sulfonačních reakcích. Tyto procesy poskytují detergenty, barviva a farmaceutika. Vyrábí se in situ z kyseliny sírové nebo se používá jako dýmavý roztok kyseliny sírové.
Znečištění ovzduší oxidy síry je hlavním problémem životního prostředí a každý rok se do ovzduší vypouštějí miliony tun oxidu siřičitého a trioxidu. Tyto sloučeniny jsou škodlivé pro život rostlin a zvířat, stejně jako pro mnoho stavebních materiálů.
Dalším velkým problémem, který je třeba zvážit, jsou kyselé deště. Oba oxidy síry se rozpouštějí v atmosférických vodních kapičkách a vytvářejí kyselé roztoky, které mohou být při distribuci ve formě deště velmi škodlivé..
Předpokládá se, že kyselina sírová je hlavní příčinou kyselosti z kyselých dešťů, které mohou poškodit lesy a způsobit úhyn ryb v mnoha jezerech.
Kyselý déšť také korozivně působí na kovy, vápence a další materiály. Možná řešení tohoto problému jsou nákladná kvůli obtížnosti odstraňování síry z uhlí a ropy před jejich spalováním (Zumdahl, 2014).
Reference
- EMBL-EBI. (2016, 2. prosince). oxid sírový. Citováno z ChEBI: ebi.ac.uk
- Bezpečnostní list materiálu Oxid siřičitý. (2013, 21. května). Citováno z sciencelab: sciencelab.com
- Národní centrum pro biotechnologické informace. (2017, 24. června). Složená databáze PubChem; CID = 24682 . Citováno z PubChem: pubchem.ncbi.nlm.nih.gov
- Národní institut pro bezpečnost a ochranu zdraví při práci. (2015, 22. července). Oxid siřičitý. Citováno z cdc.gov: cdc.gov
- Royal Society of Chemistry. (2015). Oxid siřičitý. Citováno z chemspider: chemspider.com
- Oxid siřičitý. (2016). Obnoveno z chemické knihy: chemicalbook.com.
- Oxid siřičitý. (S.F.). Citováno z CAMEO: cameochemicals.noaa.gov.
- Zumdahl, S. S. (2014, 13. února). Citováno z britannica: britannica.com.

Zatím žádné komentáře