
Struktura oxidu barnatého (BaO), vlastnosti, použití, rizika

The oxid barnatý Je to anorganická pevná látka tvořená atomem baria (Ba) a atomem kyslíku (O). Jeho chemický vzorec je BaO. Je to bílá krystalická pevná látka a je hygroskopická, to znamená, že absorbuje vlhkost ze vzduchu, ale když na to reaguje, reaguje s ním..
Rychlá reakce oxidu barnatého s vodou umožňuje jeho použití v laboratořích pro chemickou analýzu k vysušení, to znamená k odstranění vody z organických rozpouštědel, což jsou kapalné sloučeniny, které slouží k rozpouštění jiných látek..

BaO se chová jako silná báze, proto reaguje s mnoha druhy kyselin. Například snadno reaguje s oxidem uhličitým COdva ze vzduchu za vzniku uhličitanu barnatého BaCO3.
Používá se při výrobě polymerů pro silové kabely a jako přísada do pryskyřic k utěsnění otvorů v zubech, které byly vytvrzeny.
Oxid barnatý (BaO) se také používá v keramickém průmyslu, a to jak pro jeho potahování glazurou, tak pro jeho výrobu. Používá se také v cementových směsích ke zvýšení pevnosti v tlaku konečného produktu..
Rejstřík článků
- 1 Struktura
- 2 Názvosloví
- 3 Fyzikální vlastnosti
- 3.1 Fyzický stav
- 3,2 Molekulová hmotnost
- 3.3 Teplota tání
- 3.4 Bod varu
- 3.5 Hustota
- 3.6 Rozpustnost
- 4 Chemické vlastnosti
- 5 Rizika
- 6 Získání
- 7 použití
- 7.1 Jako vysoušedlo pro organická rozpouštědla
- 7.2 Ve výbojkách
- 7.3 Při výrobě keramiky
- 7.4 Při přípravě cementových směsí
- 7.5 V různých aplikacích
- 8 Reference
Struktura
Oxid barnatý BaO je tvořen Ba kationtemdva+ a kyslíkový anion Odva-.
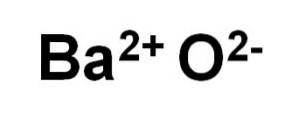
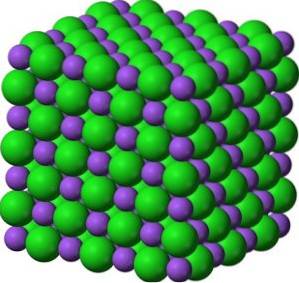
Ve svých krystalech tvoří BaO kubické iontové sítě (ve tvaru krychle) typu chloridu sodného.
Elektronová konfigurace barnatého iontu je: [Xe] 6 s0 protože ztratil dva elektrony skořápky 6s. Tato konfigurace je velmi stabilní.
Nomenklatura
-Oxid barnatý
-Oxid barnatý
Fyzikální vlastnosti
Fyzický stav
Nažloutle bílá krystalická pevná látka.
Molekulární váha
153,33 g / mol
Bod tání
1923 ° C
Bod varu
Přibližně 2 000 ° C.
Hustota
5,72 g / cm3
Rozpustnost
Mírně rozpustný ve vodě: 3,8 g / 100 ml při 20 ° C.
Chemické vlastnosti
Oxid barnatý BaO rychle reaguje s vodou, vydává teplo a vytváří korozivní roztok hydroxidu barnatého Ba (OH)dva, což je nejvíce rozpustný hydroxid z hydroxidů kovů alkalických zemin.
BaO + HdvaO → Ba (OH)dva
BaO je silná základna. Reaguje exotermicky (tj. S vývojem tepla) se všemi typy kyselin.
S COdva BaO reaguje za vzniku BaCO uhličitanu barnatého3.
BaO + COdva → BaCO3
BaO je hygroskopický, takže pokud je vystaven prostředí, spojuje se kousek po kousku s vlhkostí vzduchu a vytváří Ba (OH)dva který se kombinuje s oxidem uhličitým COdva ze vzduchu za vzniku uhličitanu barnatého BaCO3.
Když se BaO monoxid BaO zahřívá za přítomnosti vzduchu, spojuje se s kyslíkem za vzniku peroxidu barnatého BaOdva. Reakce je reverzibilní.
2 BaO + Odva ⇔ 2 BaOdva
V přítomnosti vody může reagovat s hliníkem Al nebo zinkem Zn za vzniku oxidů nebo hydroxidů uvedených kovů a generování plynného vodíku Hdva.
Může zahájit polymeraci polymerovatelných organických sloučenin, jako jsou epoxidy.
Rizika
Při požití může být toxický. Neměl by přijít do styku s pokožkou. Dráždí oči, kůži a dýchací cesty. Může být škodlivý pro nervový systém. Je schopen způsobit nízkou hladinu draslíku, což vede k poruchám srdce a svalů.
Získávání
Oxid barnatý BaO lze získat zahřátím uhličitanu barnatého BaCO3 s dřevěným uhlím. Vzniká BaO a uvolňuje se plynný oxid uhelnatý CO.
Bakchus3 + C → BaO + 2 CO ↑
Aplikace
Jako vysoušedlo pro organická rozpouštědla
Díky své snadné reakci s vodou se BaO používá od poloviny minulého století jako vysoušedlo pro benzín a zásaditá nebo neutrální organická rozpouštědla..
BaO je velmi aktivní sušení kolem sebe, velmi rychle absorbuje vlhkost, s vývojem poměrně malého množství tepla a vytváří hydroxid barnatý Ba (OH)dva který je stabilní až do asi 1 000 ° C. Z tohoto důvodu lze BaO použít při vysokých teplotách..
Má také vysokou absorpční kapacitu pro vodu. Pro každou molekulu BaO může být absorbována jedna z vody a Ba (OH)dva Výsledek může také absorbovat určité množství vody.
Je vhodný pro laboratoře analytické chemie. Nelepivý.
Může být použit v exsikátorech, což jsou velké skleněné nádoby s víkem, kde je vnitřní prostředí udržováno v suchu. BaO udržuje miniaturní atmosféru exsikátoru suchou.

Tyto exsikátory se používají k umístění látek nebo činidel a zabraňují jim tak v absorpci vody z prostředí.
Používá se také k sušení bazických plynů, jako je NH amoniak.3.
Ve výbojkách
BaO je umístěn na elektrodách výbojek jako materiál emitující elektrony.
Výbojky jsou vyrobeny ze skleněné trubice, křemene nebo jiného vhodného materiálu, obsahují inertní plyn a ve většině případů kovovou páru. Kovovou párou může být sodík nebo rtuť.

Elektrické výboje se vyskytují uvnitř trubice, protože má kladnou a zápornou elektrodu.
BaO je umístěn na elektrodách lampy. Elektrony, které emituje, se srazí s atomy par kovu a přenáší na ně energii..
Když elektrickým proudem prochází tento plyn nebo pára, vytváří se viditelné světlo nebo ultrafialové (UV) záření..
Při výrobě keramiky
BaO se používá v keramických lazurovacích nátěrových hmotách.

Bylo však také testováno jako přísada při přípravě sklokeramiky.
BaO účinně zlepšuje mechanické vlastnosti a chemickou odolnost tohoto typu keramiky. Má silný vliv na tepelné vlastnosti a složení krystalické fáze získaných materiálů..
Při přípravě cementových směsí
BaO byl testován jako složka fosfoaluminátového cementu.
Tento typ cementu je užitečný v mořském prostředí, protože nemá stejnou tendenci hydratovat jako jiné druhy cementu, takže netrpí tvorbou pórů ani expanzí..
Fosfoaluminátové cementy však musí být mechanicky zesíleny, aby odolaly mořským proudům a nárazům od plovoucích kousků ledu přítomných v oceánu..
Přidání BaO do fosfoaluminátového cementu modifikuje minerální strukturu uvedeného materiálu, zlepšuje strukturu pórů a podstatně zvyšuje pevnost v tlaku cementové pasty..
Jinými slovy, BaO zlepšuje pevnost v tlaku tohoto typu cementu..

V různých aplikacích
Používá se jako přísada k zajištění neprůhlednosti zubních pryskyřic pro vyplnění otvorů v zubech, kterou provádějí zubní lékaři.
Používá se také jako nukleační činidlo pro přípravu polymerů polyvinylidenfluoridu, které se používají k izolaci silových kabelů..
Reference
- Partyka, J. a kol. (2016). Vliv přidání BaO na slinování sklokeramických materiálů ze SiOdva-DodvaNEBO3-NadvaDOBŘEdvaSystém O-CaO / MgO. J Therm Anal Calorim (2016) 125: 1095. Obnoveno z odkazu.springer.com.
- Zhang, P. a kol. (2019). Vliv BaO na minerální strukturu a hydratační chování fosfoaluminátového cementu. J Therm Anal Calorim (2019) 136: 2319. Obnoveno z odkazu.springer.com.
- NÁS. Národní lékařská knihovna. (2019). Oxid barnatý. Obnoveno z pubchem.ncbi.nlm.nih.gov.
- Smith, N.A. (2003). Osvětlení. Zásada. V příručce elektrotechnika (šestnácté vydání). Obnoveno ze sciencedirect.com.
- Ebnesajjad, S. (2003). Fluoropolymerové pěny. Pěnící PVDF. V tavných zpracovatelných fluoroplastech. Obnoveno ze sciencedirect.com.
- Booth, H.S. a McIntyre, L.H. (1930). Oxid barnatý jako vysoušedlo. Ind. Eng. Chem. Anal. Vyd. 1930, 2, 1, 12-15. Obnoveno z pubs.acs.org.


Zatím žádné komentáře